Den tilfældige bevægelse af molekyler i et opløsningsmiddel forårsager hvad terning fast opløst stof?
* brownisk bevægelse: Den tilfældige bevægelse af molekyler i et opløsningsmiddel kaldes brownisk bevægelse. Denne konstante vridning af opløsningsmiddelmolekyler skaber kollisioner med de opløste partikler.
* solvation: Når opløsningsmiddelmolekyler kolliderer med de opløste partikler, kan de overvinde de attraktive kræfter, der holder opløsningen sammen (som ioniske bindinger eller brintbindinger). Opløsningsmiddelmolekylerne omgiver opløsningspartiklerne, danner en opløsningsskal og trækker dem effektivt væk fra den faste struktur.
* opløsning: Efterhånden som flere og flere opløste partikler er omgivet af opløsningsmiddelmolekyler, nedbrydes den faste struktur, og opløsningen opløses i opløsningsmidlet og danner en opløsning.
Vigtig note: Opløsningshastigheden påvirkes af faktorer som:
* Temperatur: Højere temperaturer øger molekylernes kinetiske energi, hvilket fører til hyppigere og energiske kollisioner og fremskynder opløsningen.
* overfladeareal: Et større overfladeareal af opløsningen giver mulighed for mere kontakt med opløsningsmiddelmolekylerne, hvilket fremskynder opløsningen.
* omrøring: Omrøring eller omrøring bringer friske opløsningsmiddelmolekyler i kontakt med opløsningen, hvilket øger opløsningshastigheden.
 Varme artikler
Varme artikler
-
 Ny metode fremskynder udviklingen af medicinI laboratoriet hos Bernhard Spingler (r.), praktikant Philipp Nievergelt (l.) ydede et vigtigt bidrag til hurtigere og lettere at bestemme krystalstrukturerne af organiske salte. Kredit:UZH Forske
Ny metode fremskynder udviklingen af medicinI laboratoriet hos Bernhard Spingler (r.), praktikant Philipp Nievergelt (l.) ydede et vigtigt bidrag til hurtigere og lettere at bestemme krystalstrukturerne af organiske salte. Kredit:UZH Forske -
 Ny, glat toiletbelægning giver renere skylning, sparer vandPenn State forskere har udviklet en metode, der dramatisk reducerer mængden af vand, der er nødvendig for at skylle et konventionelt toilet, som normalt kræver 6 liter. Kredit:Wong Laboratory for Na
Ny, glat toiletbelægning giver renere skylning, sparer vandPenn State forskere har udviklet en metode, der dramatisk reducerer mængden af vand, der er nødvendig for at skylle et konventionelt toilet, som normalt kræver 6 liter. Kredit:Wong Laboratory for Na -
 Elektronmikroskopi afslører årsagen til de lilla pletter på Alhambra-lofterneForgyldt blik på gips ved Alhambra-paladserne. (A) Generelt billede af Lions-paladset. (B) Polykrome forbliver udviser spor af lilla farve på begrænsede våde steder (sorte pile). (C) Beskadiget forgyl
Elektronmikroskopi afslører årsagen til de lilla pletter på Alhambra-lofterneForgyldt blik på gips ved Alhambra-paladserne. (A) Generelt billede af Lions-paladset. (B) Polykrome forbliver udviser spor af lilla farve på begrænsede våde steder (sorte pile). (C) Beskadiget forgyl -
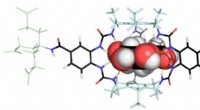 Glucosebindende molekyle kunne transformere behandlingen af diabetesReceptor bindende glucose. Kredit:University of Bristol Forskere fra University of Bristol har designet en ny syntetisk glukosebindende molekyleplatform, der bringer os et skridt tættere på udvikl
Glucosebindende molekyle kunne transformere behandlingen af diabetesReceptor bindende glucose. Kredit:University of Bristol Forskere fra University of Bristol har designet en ny syntetisk glukosebindende molekyleplatform, der bringer os et skridt tættere på udvikl
- Hvordan talegenkendelsesteknikker hjælper med at forudsige vulkaners adfærd
- Det rådgivende panel udsender feltdefinerende anbefalinger til amerikanske regeringsinvesteringer i…
- Hvad er 1 dimensionel bevægelse?
- Hvad er de fire planteprocesser?
- Det handler ikke (kun) om pengene. Det betyder noget, hvordan F&U-midler bruges også
- Religiøst engagerede unge demonstrerer vaner, der hjælper dem med at få bedre karakterer


