Hvordan ændres hastigheden af molekyler gas, når de opvarmes?
* kinetisk energi: Varme er en form for energi, og når du tilføjer varme til en gas, øger du den kinetiske energi fra dens molekyler. Kinetisk energi er bevægelsesenergien.
* hurtigere bevægelse: Når molekylerne får kinetisk energi, bevæger de sig hurtigere. Dette øgede bevægelse manifesterer sig som højere gennemsnitshastighed.
* øgede kollisioner: De hurtigere bevægende molekyler kolliderer oftere og med større kraft mod hinanden og væggene i deres beholder. Denne øgede kollisionsgrad er det, vi opfatter som højere pres.
Nøglepunkter:
* Gennemsnitlig hastighed: Vi taler om * gennemsnitlig * hastighed af gasmolekyler, fordi de konstant bevæger sig i tilfældige retninger.
* Temperatur og hastighed: Temperaturen på en gas er direkte proportional med den gennemsnitlige kinetiske energi af dens molekyler. Dette betyder, at højere temperaturer svarer til højere gennemsnitshastigheder.
* Distribution af hastigheder: Mens den gennemsnitlige hastighed stiger, bevæger molekylerne ikke alle med samme hastighed. Der er en fordeling af hastigheder, hvor nogle molekyler bevæger sig meget langsomt og andre meget hurtigt.
I resuméet øger opvarmningen af en gas hastigheden af dens molekyler på grund af stigningen i kinetisk energi, hvilket resulterer i højere tryk og en bredere fordeling af molekylhastigheder.
Sidste artikelHvad er ulemperne ved spektroskopi?
Næste artikelEr kulstof en fast flydende gas eller plasma?
 Varme artikler
Varme artikler
-
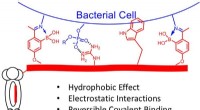 Team rapporterer teknologi, der muliggør præcisionsantibiotikaBoston College -forskere kemisk modificerede en fagvisning for at udvikle en ny tilgang til at finde specifikke bakteriestammer og målrette dem med antibiotika. Kredit: Journal of the American Chemica
Team rapporterer teknologi, der muliggør præcisionsantibiotikaBoston College -forskere kemisk modificerede en fagvisning for at udvikle en ny tilgang til at finde specifikke bakteriestammer og målrette dem med antibiotika. Kredit: Journal of the American Chemica -
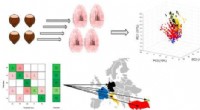 Godkendelse af hasselnøddernes geografiske oprindelseKredit:American Chemical Society Hasselnødder, som olivenolie, ost og andre landbrugsprodukter varierer i smag afhængigt af deres geografiske oprindelse. Fordi forbrugere og processorer er villige
Godkendelse af hasselnøddernes geografiske oprindelseKredit:American Chemical Society Hasselnødder, som olivenolie, ost og andre landbrugsprodukter varierer i smag afhængigt af deres geografiske oprindelse. Fordi forbrugere og processorer er villige -
 Xenon forbedrer egenskaberne af maxillofacial og ortopædiske implantaterKredit:Tomsk Polytekniske Universitet Forskere fra Tomsk Polytechnic University (TPU) studerede sammen med kollegerne fra Siberian State Medical University (SSMU) og Immanuel Kant Baltic Federal U
Xenon forbedrer egenskaberne af maxillofacial og ortopædiske implantaterKredit:Tomsk Polytekniske Universitet Forskere fra Tomsk Polytechnic University (TPU) studerede sammen med kollegerne fra Siberian State Medical University (SSMU) og Immanuel Kant Baltic Federal U -
 Datadeling er fremtiden for materialeforskningKredit: Avanceret Videnskab Brug af data til at designe og udvikle helt nye materialer er et hastigt voksende videnskabsområde. En gruppe forskere ved Aalto-universitetet har netop offentliggjort
Datadeling er fremtiden for materialeforskningKredit: Avanceret Videnskab Brug af data til at designe og udvikle helt nye materialer er et hastigt voksende videnskabsområde. En gruppe forskere ved Aalto-universitetet har netop offentliggjort
- Hvorfor inkluderer cirkulær bevægelse kontinuerlig acceleration?
- Coronavirus:Erfaringer fra Italien om vanskelighederne ved at forlade lockdown
- Hvordan endte Uranus på sin side? Vi har fundet ud af det
- Hvad er de mindste partikler mindre end 3 subatomare partikler?
- Roadmap-lækager viser BlackBerrys comeback-forsøg
- AI-assisteret robotlaboratorium udvikler nye katalysatorer til at syntetisere methanol ud fra CO₂


