Hvor mange resonansstrukturer har chlorationen, CLO31- har?
Her er hvorfor:
1. Lewis -struktur: Det centrale kloratom har tre iltatomer bundet til det, og det bærer en formel ladning på +1. Det ene iltatom har en enkelt binding og en formel ladning på -1, mens de to andre iltatomer har dobbeltbindinger og en formel afgift på 0.
2. Resonans: Dobbeltbindingerne kan forskydes mellem iltatomerne. Da dobbeltbindingerne er delokaliseret, kan vi tegne fire forskellige strukturer, der repræsenterer den faktiske struktur af chlorationen.
Vigtig note: Resonansstrukturer er ikke reelle, individuelle strukturer. De er bare en måde at repræsentere delokalisering af elektroner i et molekyle. Den faktiske struktur af chlorationen er en hybrid af alle fire resonansstrukturer.
Sidste artikelHvad er de to metalstykker i en termostat?
Næste artikelFlytter molekyle hurtigere ved høje eller lave temperaturer?
 Varme artikler
Varme artikler
-
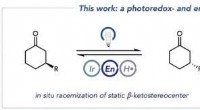 Forskere rapporterer om ny platform for stereokontrolDen overordnede transformation, der kombinerer racemisering af ketonsubstraterne (til venstre) med biokatalytisk reduktion til enantiomert rene alkoholprodukter (i midten), og den vigtigste enaminylra
Forskere rapporterer om ny platform for stereokontrolDen overordnede transformation, der kombinerer racemisering af ketonsubstraterne (til venstre) med biokatalytisk reduktion til enantiomert rene alkoholprodukter (i midten), og den vigtigste enaminylra -
 Forskere udvikler molekylær kode for melanin-lignende materialerPolymere pigmenter blev fremstillet ved guidet oxidation af peptidsamlinger. Kredit:Matej Vakula, NYC Forskere har længe vidst, at melanin - de pigmenter, der giver farve til huden, hår og øjne -
Forskere udvikler molekylær kode for melanin-lignende materialerPolymere pigmenter blev fremstillet ved guidet oxidation af peptidsamlinger. Kredit:Matej Vakula, NYC Forskere har længe vidst, at melanin - de pigmenter, der giver farve til huden, hår og øjne - -
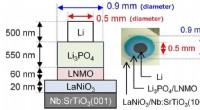 Udvidelse af grænserne for Li-ion-batterier – elektroder til hel-solid-state batterierBatterierne blev fremstillet ved at stable forskellige lag via tynd-film aflejringsmetoder. LNMO/Li 3 PO 4 grænsefladen viste spontan migration af Li-ioner og havde en hidtil uset lav modstand. Kr
Udvidelse af grænserne for Li-ion-batterier – elektroder til hel-solid-state batterierBatterierne blev fremstillet ved at stable forskellige lag via tynd-film aflejringsmetoder. LNMO/Li 3 PO 4 grænsefladen viste spontan migration af Li-ioner og havde en hidtil uset lav modstand. Kr -
 Sneeze cam afslører de bedste stofkombinationer til stofmaskerKredit:Pixabay/CC0 Public Domain Under COVID-19-pandemien, Stof ansigtsmasker blev en måde at hjælpe med at beskytte dig selv og andre mod virussen. Og for nogle mennesker, de blev et fashion stat
Sneeze cam afslører de bedste stofkombinationer til stofmaskerKredit:Pixabay/CC0 Public Domain Under COVID-19-pandemien, Stof ansigtsmasker blev en måde at hjælpe med at beskytte dig selv og andre mod virussen. Og for nogle mennesker, de blev et fashion stat


