Ved hvilken temperatur C vil xenon -atomer have den samme gennemsnitlige hastighed, som CL2 -molekyler ved C?
forståelse af koncepterne
* Gennemsnitlig hastighed for gasmolekyler: Den gennemsnitlige hastighed for gasmolekyler er relateret til deres temperatur. Jo højere temperatur, jo hurtigere bevæger molekylerne sig i gennemsnit.
* rod-middel-kvadrathastighed: En almindelig måde at udtrykke den gennemsnitlige hastighed for gasmolekyler er rod-middel-kvadrathastigheden (URMS). Det beregnes ved hjælp af følgende ligning:
Urms =√ (3RT/M)
hvor:
* URMS =rod-middel-kvadrathastighed (M/s)
* R =ideel gaskonstant (8.314 j/mol · k)
* T =temperatur (k)
* M =molmasse (kg/mol)
Opsætning af problemet
Vi ønsker, at de gennemsnitlige hastigheder for xenon -atomer (XE) og chlormolekyler (CL2) skal være ens:
URMS (XE) =URMS (CL2)
Beregninger
1. Molmasser:
* XE:131,29 g/mol =0,13129 kg/mol
* Cl2:70,90 g/mol =0,07090 kg/mol
2. Opret ligningen:
√ (3r * t (xe) / m (xe)) =√ (3r * t (cl2) / m (cl2))
3. Forenkle: Da begge sider har √ (3R), kan vi annullere dem:
T (xe) / m (xe) =t (cl2) / m (cl2)
4. Løs for t (xe):
T (xe) =(m (xe) / m (cl2)) * t (cl2)
T (xe) =(0,13129 kg/mol/0,07090 kg/mol) * t (cl2)
T (xe) ≈ 1,85 * t (cl2)
Konklusion
Xenon -atomer vil have den samme gennemsnitlige hastighed som klormolekyler ved en temperatur, der er ca. 1,85 gange højere end temperaturen på klormolekylerne.
Vigtig note: Denne løsning antager ideel gasadfærd. I virkeligheden kan afvigelser fra ideel opførsel forekomme ved meget høje temperaturer eller tryk.
 Varme artikler
Varme artikler
-
 Hvordan bakterier defuserer hypothiocyanit, et antimikrobielt våben fra det medfødte immunsystemKredit:Pixabay/CC0 Public Domain Hvordan overlever en bred vifte af bakterier - både patogene og kommensale - antimikrobielle stoffer frigivet af pattedyrets medfødte immunsystem? Svaret for et af
Hvordan bakterier defuserer hypothiocyanit, et antimikrobielt våben fra det medfødte immunsystemKredit:Pixabay/CC0 Public Domain Hvordan overlever en bred vifte af bakterier - både patogene og kommensale - antimikrobielle stoffer frigivet af pattedyrets medfødte immunsystem? Svaret for et af -
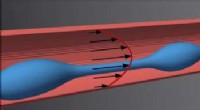 Fysikere opdager mekanismer til dannelse af blodpladerIndividuelle dråber dannes af en aflang fingerformet celle (blå) i blodgennemstrømningen. Hver dråbe udvikler sig til en blodplade. Billede:UBT / Christian Bächer. Kredit:University of Bayreuth Bl
Fysikere opdager mekanismer til dannelse af blodpladerIndividuelle dråber dannes af en aflang fingerformet celle (blå) i blodgennemstrømningen. Hver dråbe udvikler sig til en blodplade. Billede:UBT / Christian Bächer. Kredit:University of Bayreuth Bl -
 Dette computerprogram gør pharma patenter lufttættehans grafiske abstrakt illustrerer, hvordan ved at identificere og holde styr på vigtige afbrydelser, der er afgørende for patentbeskyttede synteser, et retrosyntetisk computerprogram kan autonomt des
Dette computerprogram gør pharma patenter lufttættehans grafiske abstrakt illustrerer, hvordan ved at identificere og holde styr på vigtige afbrydelser, der er afgørende for patentbeskyttede synteser, et retrosyntetisk computerprogram kan autonomt des -
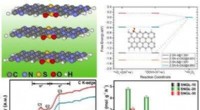 Forskere indser effektiv hydrogenperoxidproduktion i syreIllustration af forskningen. Kredit:Prof. Guans gruppe Som et af de 100 vigtigste kemikalier i verden er hydrogenperoxid (H2 O2 ) fremstilles hovedsageligt ved den energi- og affaldsintensive anthr
Forskere indser effektiv hydrogenperoxidproduktion i syreIllustration af forskningen. Kredit:Prof. Guans gruppe Som et af de 100 vigtigste kemikalier i verden er hydrogenperoxid (H2 O2 ) fremstilles hovedsageligt ved den energi- og affaldsintensive anthr
- Laboratorielovens eksperiment er isotermisk fænomen eller ændring giver fornuft?
- Freelanceøkonomien med høje kvalifikationer stiger, efterhånden som digitale talentplatforme hjæ…
- Hvad er stivheden af et materiale?
- Hvad er beta -partikler?
- Er grafit -stødende sedimentær eller metamorf?
- Laserdrevet spindynamik i ferrimagneter:Hvordan flyder vinkelmomentet?


