Hvad sker der med den kinetiske energi fra partikler et stof som ændringer fra flydende gas?
* Breaking intermolekylære kræfter: I en væske er partikler tæt sammen og holdes af relativt stærke intermolekylære kræfter (som brintbindinger, dipol-dipolinteraktioner eller London-spredningskræfter). For at skifte til en gas skal disse kræfter overvindes.
* Øget molekylær bevægelse: Når partiklerne får energi, bevæger de sig hurtigere og længere fra hinanden og overvinder de intermolekylære attraktioner. Denne øgede bevægelse er det, der kendetegner en gas, hvor partikler frit kan bevæge sig i alle retninger.
* Energiindgang: Den energi, der er nødvendig for at bryde de intermolekylære kræfter og øge partiklernes kinetiske energi, kommer fra omgivelserne. Dette kan være i form af varmeenergi (som når du koger vand) eller på andre måder som reduceret tryk.
Kortfattet:
* væske til gasovergang kræver en stigning i partiklernes kinetiske energi.
* Denne energiforøgelse giver partiklerne mulighed for at overvinde intermolekylære kræfter og bevæge sig frit, hvilket resulterer i den gasformige tilstand.
 Varme artikler
Varme artikler
-
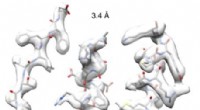 Kryo-EM-billeder i høj opløsning fra Afrika baner vejen for skræddersyede nitrilaser til industri…Ved at maskere en enkelt spiralformet drejning og behandle dette som en enkelt partikel, forskerne var i stand til at forbedre opløsningen væsentligt. Kredit:Diamond lyskilde Et team fra Cape Town
Kryo-EM-billeder i høj opløsning fra Afrika baner vejen for skræddersyede nitrilaser til industri…Ved at maskere en enkelt spiralformet drejning og behandle dette som en enkelt partikel, forskerne var i stand til at forbedre opløsningen væsentligt. Kredit:Diamond lyskilde Et team fra Cape Town -
 Forskere bruger maskinlæring til at identificere højtydende solcellerArgonne-forskere bruger maskinlæring og datamining i forbindelse med simuleringer og eksperimenter i stor skala til at identificere nye lysabsorberende farvestofmolekyler til solcelledrevne vinduer. K
Forskere bruger maskinlæring til at identificere højtydende solcellerArgonne-forskere bruger maskinlæring og datamining i forbindelse med simuleringer og eksperimenter i stor skala til at identificere nye lysabsorberende farvestofmolekyler til solcelledrevne vinduer. K -
 Hurtig urintest for amfetamin sender resultater via appDenne figur repræsenterer den nyudviklede amfetaminsensor med et trådløst kommunikationssystem. Lægemiddelsensoren består af en meget følsom organisk transistorplatform funktionaliseret med lægemiddel
Hurtig urintest for amfetamin sender resultater via appDenne figur repræsenterer den nyudviklede amfetaminsensor med et trådløst kommunikationssystem. Lægemiddelsensoren består af en meget følsom organisk transistorplatform funktionaliseret med lægemiddel -
 Faseovergangsdynamik i todimensionelle materialerMolekyler af monolag molybdendisulfid (MoS2) og wolframdiselenid (WSe2) oven på et metalsubstrat. Kredit:National University of Singapore Forskere fra National University of Singapore har opdaget
Faseovergangsdynamik i todimensionelle materialerMolekyler af monolag molybdendisulfid (MoS2) og wolframdiselenid (WSe2) oven på et metalsubstrat. Kredit:National University of Singapore Forskere fra National University of Singapore har opdaget
- Hvordan sammenligner afstanden mellem jord og sol med Jorden Nerby -stjerner galakser?
- Når rockfragmenter er fastlagt på et nyt sted?
- Hvad er en stjerne, der tæt på 10000 grader vores sol denne farvestjerne?
- Hvordan får temperaturændringer sten til at knække?
- Når en kraft er stærkere eller større end en anden, siger vi, at kræfterne er det?
- Små mikrojordskælv gør grundvandet surt


