Hvad tror du vil ske med temperaturen på et stof under faseændring?
Her er hvorfor:
* Energi bruges til at bryde eller danne obligationer: Faseændringer involverer brud eller dannelse af intermolekylære bindinger. For eksempel, når is smelter, går den leverede energi til at bryde brintbindingerne, der holder vandmolekylerne i en solid struktur.
* Ingen stigning i kinetisk energi: Denne energiindgang øger ikke molekylernes kinetiske energi (hvilket er det, vi opfatter som temperatur). I stedet bruges det til at ændre stoftilstand.
* plateau på opvarmningskurver: Denne konstante temperatur under faseændring afspejles i platået, der ses på opvarmningskurver, hvor temperaturen forbliver stabil, selvom der stadig tilsættes varme.
Eksempler:
* smeltning: Is smelter i vandet.
* kogning: Vand kogende i damp.
* Frysning: Vandfrysning i is.
* kondens: Dampkondensering i vand.
Fortæl mig, hvis du gerne vil have flere detaljer om nogen af disse processer!
Sidste artikelHvad har væske en bestemt form eller volumen?
Næste artikelHvad er et fluorescerende uransalt?
 Varme artikler
Varme artikler
-
 Biokatalyse:Ny metode til at drive katalytisk aktive enzymerMarco Krewing, Abdulkadir Yayci og Julia Bandow forsker i muligheder for miljøvenlig katalyse med enzymer. Kredit:RUB, Marquard Et forskerhold fra Bochum har udviklet en ny metode til at drive kat
Biokatalyse:Ny metode til at drive katalytisk aktive enzymerMarco Krewing, Abdulkadir Yayci og Julia Bandow forsker i muligheder for miljøvenlig katalyse med enzymer. Kredit:RUB, Marquard Et forskerhold fra Bochum har udviklet en ny metode til at drive kat -
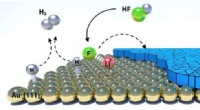 Batteriets skjulte lag afsløretReaktionsmekanismen til omdannelse af hydrogenfluorid (HF) urenhed fra elektrolytten til lithiumfluorid (LiF) i fast-elektrolytinterfasen (SEI) med frigivelse af hydrogengas (H2). SEI -laget er vist p
Batteriets skjulte lag afsløretReaktionsmekanismen til omdannelse af hydrogenfluorid (HF) urenhed fra elektrolytten til lithiumfluorid (LiF) i fast-elektrolytinterfasen (SEI) med frigivelse af hydrogengas (H2). SEI -laget er vist p -
 Feltresponsive mekaniske metamaterialer (FRMM'er)Struktur og reologiske test af MR-væske som reaktion på påførte magnetiske felter. (A) Optisk billede af MR-væsken, der danner en væskepool på et plant substrat i fravær af et magnetfelt. (B) Optisk b
Feltresponsive mekaniske metamaterialer (FRMM'er)Struktur og reologiske test af MR-væske som reaktion på påførte magnetiske felter. (A) Optisk billede af MR-væsken, der danner en væskepool på et plant substrat i fravær af et magnetfelt. (B) Optisk b -
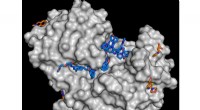 Nyt stofbibliotek for at fremskynde søgningen efter aktive stofferTil studiet, enzymet endothiapepsin (grå) blev kombineret med molekyler fra fragmentbiblioteket. Analysen viser, at adskillige stoffer er i stand til at koble sig til enzymet (blå og orange molekyler)
Nyt stofbibliotek for at fremskynde søgningen efter aktive stofferTil studiet, enzymet endothiapepsin (grå) blev kombineret med molekyler fra fragmentbiblioteket. Analysen viser, at adskillige stoffer er i stand til at koble sig til enzymet (blå og orange molekyler)


