Hvilken slags kraft fungerer inden for et molekyle?
* intramolekylære kræfter: Dette er de kræfter, der holder atomer sammen i et molekyle. De er meget stærkere end intermolekylære kræfter, der holder molekyler sammen. De to hovedtyper af intramolekylære kræfter er:
* kovalente obligationer: Dette er den stærkeste type kemisk binding, dannet ved deling af elektroner mellem atomer. De er ansvarlige for dannelsen af de fleste molekyler.
* ioniske bindinger: Disse bindinger dannes af den elektrostatiske tiltrækning mellem modsat ladede ioner. De findes typisk i forbindelser dannet mellem metaller og ikke -metaller.
* Andre intramolekylære interaktioner: Foruden kovalente og ioniske bindinger kan andre kræfter også bidrage til stabiliteten og egenskaberne ved et molekyle. Disse inkluderer:
* Hydrogenbinding: Dette er en speciel type dipol-dipolinteraktion, der opstår, når et hydrogenatom er bundet til et meget elektronegativt atom (som ilt, nitrogen eller fluor). Det er en relativt stærk intermolekylær kraft, men stadig svagere end kovalente bindinger.
* van der Waals Forces: Dette er svage, midlertidige kræfter, der opstår ved udsving i elektronfordeling omkring atomer. De er vigtige for at holde molekyler sammen i væsker og faste stoffer.
Kortfattet: Mens kovalente bindinger er den primære kraft, der er ansvarlige for dannelsen og stabiliteten af molekyler, kan andre intramolekylære interaktioner som hydrogenbinding og van der Waals kræfter også spille betydelige roller i bestemmelsen af et molekyls egenskaber.
Sidste artikelMassen af et kvantitetsstof er?
Næste artikelHvad er bølgelængden af nitrogen?
 Varme artikler
Varme artikler
-
 Syntesemetode udvider materielle mulighederSkema, der beskriver infiltrationssynteseprocessen til fremstilling af nye materialer. Top:Generering af en organisk-uorganisk hybrid ved infiltrering af uorganiske forstadier (udgangsmaterialer) til
Syntesemetode udvider materielle mulighederSkema, der beskriver infiltrationssynteseprocessen til fremstilling af nye materialer. Top:Generering af en organisk-uorganisk hybrid ved infiltrering af uorganiske forstadier (udgangsmaterialer) til -
 Beregningsværktøjer og nye strategier gør opdagelse af lægemidler mere effektivKredit:CC0 Public Domain Den kemiske industri har kun ridset overfladen af mulige molekyler, der kunne bruges som lægemidler, hvilket er ufatteligt større end antallet af stjerner i universet. Fo
Beregningsværktøjer og nye strategier gør opdagelse af lægemidler mere effektivKredit:CC0 Public Domain Den kemiske industri har kun ridset overfladen af mulige molekyler, der kunne bruges som lægemidler, hvilket er ufatteligt større end antallet af stjerner i universet. Fo -
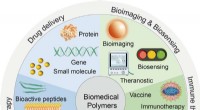 Biomedicinske polymerer:syntese, egenskaber og anvendelserSkematisk illustration af smarte polymerer til biomedicinske applikationer. Kredit:Science China Press Biomedicinske polymerer er blevet omfattende udviklet til lovende anvendelser inden for en mas
Biomedicinske polymerer:syntese, egenskaber og anvendelserSkematisk illustration af smarte polymerer til biomedicinske applikationer. Kredit:Science China Press Biomedicinske polymerer er blevet omfattende udviklet til lovende anvendelser inden for en mas -
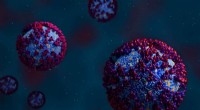 Brug af matematik til at forudsige SARS-CoV-2-proteinmutationerEt team af forskere brugte matematik til at forudsige, hvilke områder af SARS-CoV-2 spike-proteinet der er mest tilbøjelige til at mutere. Kredit:Jill Hemman/ORNL, U.S.A. Dept. of Energy Oak Ridge
Brug af matematik til at forudsige SARS-CoV-2-proteinmutationerEt team af forskere brugte matematik til at forudsige, hvilke områder af SARS-CoV-2 spike-proteinet der er mest tilbøjelige til at mutere. Kredit:Jill Hemman/ORNL, U.S.A. Dept. of Energy Oak Ridge
- Er D5 0,3 NaCl en hypotonisk løsning?
- Kraftfuldt nyt datasæt afslører mønstre af global ozonforurening
- Når coronavirus ikke er alene:Team af kompleksitetsforskere præsenterer mememodel for flere sygdom…
- Den amerikanske oliepris styrtdykker:Hvad betyder det?
- Obama vil binde Trumps hænder på Arktis, Atlanterhavsboring
- Ecuador:Skovrydning ødelægger mere tør skov end klimaændringer


