Brug af Gibbs Free Energy -ligning Hvad er ændringen til syntese af kulstofdisulfid ved 25C?
1. Skriv den afbalancerede kemiske ligning:
Syntesen af kulstofdisulfid fra dets elementer er:
C (S) + 2S (S) → CS₂ (L)
2. Saml Standard Gibbs Gratis energi af formationsværdier:
Du har brug for den standard Gibbs fri energien til dannelse (ΔG ° F) for hver komponent i reaktionen. Disse værdier findes typisk i termodynamiske tabeller. Her er et almindeligt sæt værdier:
* ΔG ° f [c (s)] =0 kJ/mol (pr. Definition er standardtilstanden for et element 0)
* ΔG ° f [s (s)] =0 kJ/mol (det samme som ovenfor)
* ΔG ° f [cs₂ (l)] =+65,3 kJ/mol
3. Anvend Gibbs Free Energy -ligningen:
Gibbs frie energiændring for en reaktion (ΔG °) beregnes som:
ΔG ° =σnΔg ° F (produkter) - σmΔg ° F (reaktanter)
hvor:
* n og m er de støkiometriske koefficienter i den afbalancerede ligning
* ΔG ° f er den standard Gibbs Free Energy of Formation
4. Erstatter værdier og beregner:
ΔG ° =(1 * ΔG ° F [CS₂ (L)]) - (1 * ΔG ° F [C (S)] + 2 * ΔG ° F [S)])
ΔG ° =(1 * 65,3 kJ/mol) - (1 * 0 kJ/mol + 2 * 0 kJ/mol)
ΔG ° =65,3 kJ/mol
Derfor er ændringen i Gibbs fri energi til syntese af kulstofdisulfid ved 25 ° C +65,3 kJ/mol.
Fortolkning:
* positiv ΔG °: Dette indikerer, at reaktionen er ikke-spontan under standardbetingelser (25 ° C og 1 atm). Med andre ord kræves energiindgang for at føre reaktionen fremad.
Vigtige noter:
* Gibbs -frie energiligning antager standardbetingelser (25 ° C og 1 atm). For andre forhold skal du bruge Gibbs Free Energy -ligningen med de passende temperatur- og trykværdier.
* Den faktiske spontanitet af en reaktion kan påvirkes af faktorer som koncentration, tryk og temperatur. Gibbs Free Energy -ligningen giver et godt udgangspunkt, men kan være nødvendige justeringer for specifikke betingelser.
 Varme artikler
Varme artikler
-
 Optiske overtoner til solcellerAnalogt med et fænomen kendt for musikinstrumenter, når overtoner af to forskellige grundtoner kommer i resonans, forskere fra LMU München har fundet en ny effekt med hensyn til optisk excitation af l
Optiske overtoner til solcellerAnalogt med et fænomen kendt for musikinstrumenter, når overtoner af to forskellige grundtoner kommer i resonans, forskere fra LMU München har fundet en ny effekt med hensyn til optisk excitation af l -
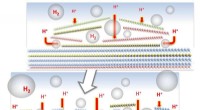 Bobler hjælper nye katalysatorer med at optimere sig selvEn elektrokatalysator skabt ved Rice University viste sig at være lige så effektiv som platin til produktion af brint. Processen skaber brintbobler mellem planer af det lagdelte materiale, som bryder
Bobler hjælper nye katalysatorer med at optimere sig selvEn elektrokatalysator skabt ved Rice University viste sig at være lige så effektiv som platin til produktion af brint. Processen skaber brintbobler mellem planer af det lagdelte materiale, som bryder -
 Forfølger sikrere, billigere lægemidler via elektromagnetisk kontrol på atomniveauForskningen ledet af Dr. Shoufeng Lan kunne producere sikrere, mindre dyre generiske lægemidler. Kredit:Texas A&M Engineering almindelige lægemidler, såsom ibuprofen, kan bære en iboende fejl i de
Forfølger sikrere, billigere lægemidler via elektromagnetisk kontrol på atomniveauForskningen ledet af Dr. Shoufeng Lan kunne producere sikrere, mindre dyre generiske lægemidler. Kredit:Texas A&M Engineering almindelige lægemidler, såsom ibuprofen, kan bære en iboende fejl i de -
 Forskere skaber en kemisk rumkortlægningsmetode og knækker mysteriet om Mendeleev-nummeretKort over sammensat hårdhed. Kredit:Artem R. Oganov Forskere har længe søgt efter et system til at forudsige materialers egenskaber baseret på deres kemiske sammensætning. I særdeleshed, de sætter
Forskere skaber en kemisk rumkortlægningsmetode og knækker mysteriet om Mendeleev-nummeretKort over sammensat hårdhed. Kredit:Artem R. Oganov Forskere har længe søgt efter et system til at forudsige materialers egenskaber baseret på deres kemiske sammensætning. I særdeleshed, de sætter
- Astronomer opdager tegn på supermassive sorte hul-fusioner
- Hvor er stofskiftet placeret?
- NASAs Swift suspenderer midlertidigt videnskabelige operationer
- Hvor mange ounces i en og en halv gram?
- En bil starter fra hvile med en konstant acceleration på 5 ms2 Hvor meget tid tager det at dække d…
- En AI-teknologi til at afsløre karakteristika for dyrs adfærd


