Hvor meget NH3 er nødvendig for at reagere nøjagtigt med 21 gram CH3OH?
1. Skriv den afbalancerede kemiske ligning:
Reaktionen mellem methanol (CH3OH) og ammoniak (NH3) producerer methylamin (CH3NH2) og vand (H2O).
CH3OH + NH3 → CH3NH2 + H2O
2. Beregn den molære masse af hver reaktant:
* CH3OH (methanol):12,01 g/mol (C) + 4,03 g/mol (H) + 16,00 g/mol (O) =32,04 g/mol
* NH3 (ammoniak):14,01 g/mol (N) + 3,02 g/mol (H) =17,03 g/mol
3. Konverter massen af methanol til mol:
* Mol Ch3OH =(Mass of CH3OH) / (Molær masse af CH3OH)
* Mol CH3OH =21 g / 32,04 g / mol =0,655 mol
4. Bestem molforholdet fra den afbalancerede ligning:
* Den afbalancerede ligning viser et forhold på 1:1 mol mellem CH3OH og NH3. Dette betyder, at du for hver 1 mol CH3OH har brug for 1 mol NH3.
5. Beregn molen af NH3 nødvendigt:
* Da molforholdet er 1:1, har du brug for 0,655 mol NH3.
6. Konverter molen af NH3 til gram:
* Masse af NH3 =(mol NH3) * (Molær masse af NH3)
* Masse NH3 =0,655 mol * 17,03 g/mol =11,15 g
Derfor har du brug for cirka 11,15 gram NH3 for at reagere nøjagtigt med 21 gram CH3OH.
 Varme artikler
Varme artikler
-
 Smart løsning til at opdage fordærvelse af skaldyrKredit:CC0 Public Domain Vigtigt, Flinders Universitys professor i akvakultur Jian Qin - der ledede undersøgelsen sammen med Flinders kollega professor Youhong Tang - siger, at denne enkle enhed k
Smart løsning til at opdage fordærvelse af skaldyrKredit:CC0 Public Domain Vigtigt, Flinders Universitys professor i akvakultur Jian Qin - der ledede undersøgelsen sammen med Flinders kollega professor Youhong Tang - siger, at denne enkle enhed k -
 Forskere laver plastik af sukker og kuldioxidSukker og kuldioxid er hovedingredienserne i den nye bionedbrydelige plast. Kredit:fcafotodigital Noget biologisk nedbrydeligt plastik kan i fremtiden fremstilles ved hjælp af sukker og kuldioxid,
Forskere laver plastik af sukker og kuldioxidSukker og kuldioxid er hovedingredienserne i den nye bionedbrydelige plast. Kredit:fcafotodigital Noget biologisk nedbrydeligt plastik kan i fremtiden fremstilles ved hjælp af sukker og kuldioxid, -
 Mere bæredygtig genanvendelse af plastMobiltelefonetui lavet med 3D-print, ved brug af genbrugsplast. Kredit:Copyright:AG Mecking, Universitetet i Konstanz Plast er blandt de mest brugte materialer, og de er vitale komponenter i alle
Mere bæredygtig genanvendelse af plastMobiltelefonetui lavet med 3D-print, ved brug af genbrugsplast. Kredit:Copyright:AG Mecking, Universitetet i Konstanz Plast er blandt de mest brugte materialer, og de er vitale komponenter i alle -
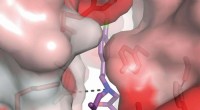 Målrettet skjult lomme til behandling af slagtilfælde og anfaldEn kemisk forbindelse i 93-serien slutter sig til en neurons NMDA-receptor. Forbindelser som denne har en høj affinitet for receptoren på grund af et unikt motiv, der trækkes ind i en skjult lomme (il
Målrettet skjult lomme til behandling af slagtilfælde og anfaldEn kemisk forbindelse i 93-serien slutter sig til en neurons NMDA-receptor. Forbindelser som denne har en høj affinitet for receptoren på grund af et unikt motiv, der trækkes ind i en skjult lomme (il
- Hvor er det elektriske felt omkring en ladet obhekt mest intens?
- Nye farvesorterere i nano fra Molecular Foundry
- Hvordan mærker insekter varmen?
- Nye flyvende krybdyrarter var et af de største flyvende dyr nogensinde
- Soludbrud kan alle have den samme udløser
- Skelne mellem masse og momentum, som er inerti, der er på bevægelse?


