Hvad menes med latent fusionsvarme og forklare det molekylær teori betyder noget?
Latent Fusionsvarme forklaret:
Den latente fusionsvarme er den mængde energi, der kræves for at ændre et stof fra en fast tilstand til en flydende tilstand ved en konstant temperatur. Det er i det væsentlige den energi, der er nødvendig for at bryde bindingerne, der holder molekylerne i en stiv, ordnet struktur (fast) og giver dem mulighed for at bevæge sig mere frit (væske).
Tænk på det sådan: Forestil dig en isblok. For at smelte det skal du tilføje varmeenergi. Denne energi øger ikke temperaturen på isen, men i stedet bryder den bindingerne, der holder vandmolekylerne sammen i den faste isstruktur. Når nok bindinger er brudt, omdannes isen til flydende vand, selvom temperaturen forbliver ved smeltepunktet (0 ° C for vand).
Forklaring af latent fusionsvarme med molekylær teori om stof:
Den molekylære teori om stof forklarer materialens opførsel på atom- og molekylært niveau. Sådan relaterer det sig til latent fusionsvarme:
faste stoffer:
* bestilt struktur: I faste stoffer er molekyler tæt pakket og holdes sammen af stærke intermolekylære kræfter. Disse kræfter skaber en stiv, ordnet struktur.
* Lav mobilitet: Molekyler i et fast stof har meget begrænset bevægelse og vibrerer kun inden for deres faste positioner.
væsker:
* mindre rækkefølge: I væsker er molekyler stadig tæt på hinanden, men har større bevægelsesfrihed. De intermolekylære kræfter er svagere sammenlignet med faste stoffer.
* Højere mobilitet: Molekyler i en væske kan bevæge sig rundt, glide forbi hinanden og have mere translationel og rotationsbevægelse.
smeltning:
* Energiindgang: Når der tilsættes varme til et fast stof, absorberes energien af molekylerne, hvilket får dem til at vibrere hurtigere.
* Bond Breaking: Når vibrationerne øges, svækkes de intermolekylære kræfter og går til sidst. Det er her den latente fusionsvarme bruges.
* faseændring: Når nok bindinger brydes, kollapseres den faste struktur, og stoffet overgår til en flydende tilstand. Temperaturen forbliver konstant i denne faseændring, fordi den tilsatte energi helt bruges til at bryde bindinger, ikke til at øge molekylernes kinetiske energi (hvilket ville øge temperaturen).
Vigtige punkter:
* Konstant temperatur: Den latente fusionsvarme er en konstant værdi for et givet stof ved et specifikt tryk. Dette betyder, at stoffets temperatur forbliver den samme under smelteprocessen.
* Varmeabsorption: Under smeltning absorberer stoffet varmeenergi uden at øge dets temperatur.
* endotermisk proces: Meltning er en endotermisk proces, fordi den kræver energiindgang.
Eksempel:
Den latente fusionsvarme for vand er 334 J/g. Dette betyder, at 334 Joules of Energy er påkrævet for at smelte et gram is ved 0 ° C i flydende vand ved 0 ° C.
I resuméet er den latente fusionsvarme den energi, der kræves for at bryde bindingerne, der holder molekylerne i en solid struktur, hvilket giver dem mulighed for at bevæge sig mere frit i en flydende tilstand. Den molekylære teori om stof hjælper os med at forstå, hvordan denne energi bruges til at overvinde de intermolekylære kræfter og lette faseændringen.
Sidste artikelHvor meget NH3 er nødvendig for at reagere nøjagtigt med 21 gram CH3OH?
Næste artikelHvilken gas bliver kalkvandsmælkehvid?
 Varme artikler
Varme artikler
-
 Forskere opdager en ny måde at splitte og summe fotoner med siliciumSilicium -nanokrystaller dannes af en silangas i en plasmaprocess. Kredit:Lorenzo Mangolini/UC Riverside Et team af forskere ved The University of Texas i Austin og University of California, River
Forskere opdager en ny måde at splitte og summe fotoner med siliciumSilicium -nanokrystaller dannes af en silangas i en plasmaprocess. Kredit:Lorenzo Mangolini/UC Riverside Et team af forskere ved The University of Texas i Austin og University of California, River -
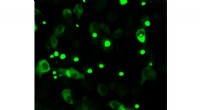 Ny indsigt i Huntingtons sygdomHumane celler, der producerer fluorescens-mærket mutant huntingtin. Muteret huntingtin har en tendens til at akkumulere, hvilket er patologisk og synligt i form af prikker. Kredit:Bremen Universitet
Ny indsigt i Huntingtons sygdomHumane celler, der producerer fluorescens-mærket mutant huntingtin. Muteret huntingtin har en tendens til at akkumulere, hvilket er patologisk og synligt i form af prikker. Kredit:Bremen Universitet -
 Ny teknik åbner nye forskningsmuligheder for nye lægemidler og velsmagende madKredit:Wageningen University Forskere ved Wageningen University har udviklet en ny teknik, der åbner nye muligheder for forskning i nye lægemidler og mere velsmagende, sundere mad. Den nye tilgang
Ny teknik åbner nye forskningsmuligheder for nye lægemidler og velsmagende madKredit:Wageningen University Forskere ved Wageningen University har udviklet en ny teknik, der åbner nye muligheder for forskning i nye lægemidler og mere velsmagende, sundere mad. Den nye tilgang -
 En udåndingstest for Parkinsons tidligt stadieKredit:American Chemical Society Symptomer på Parkinsons sygdom omfatter tremor, lugttab og neuropsykiatriske problemer. Imidlertid, mange mennesker bliver ikke diagnosticeret, før deres sygdom er
En udåndingstest for Parkinsons tidligt stadieKredit:American Chemical Society Symptomer på Parkinsons sygdom omfatter tremor, lugttab og neuropsykiatriske problemer. Imidlertid, mange mennesker bliver ikke diagnosticeret, før deres sygdom er
- Hvorfor er der konflikter om miljøet?
- Monaco udruller Huawei-bygget 5G-netværk i europæisk først
- Hvad er varme eller elektrisk overførsel ved kontakt?
- Nogle planetariske systemer er bare ikke til heavy metal
- Hvad skal der ske for speciation?
- Hvor varmt er en skydestjerne, når den striber over nattehimlen?


