Hvordan opfører sig et atom, hvis den havde en fuld oktet af valenselektroner?
* octet regel: Atomer stræber efter at opnå en stabil elektronkonfiguration svarende til de ædle gasser, der har en fuld ydre skal af elektroner. Dette er kendt som Octet -reglen (undtagen brint og helium, der har en duet).
* stabil elektronkonfiguration: En fuld octet betyder, at atomets yderste energiniveau er fuldstændigt fyldt. Denne ordning gør det vanskeligt at få eller miste elektroner.
* Lav reaktivitet: Fordi atomet allerede er stabilt, danner det ikke let kemiske bindinger. Dette gør det ureaktivt.
Eksempler:
* ædle gasser: De ædle gasser (He, NE, AR, KR, XE, RN) har som standard en fuld oktet. Derfor er de meget ureaktive.
* fluor (F): Fluor har 7 valenselektroner. Det får let et elektron for at afslutte sin oktet og blive fluorion ion (F-), som er meget stabil.
Undtagelser fra Octet -reglen:
* elementer i perioder 3 og derover: Disse elementer kan rumme mere end 8 valenselektroner på grund af tilgængeligheden af D -orbitaler.
* brint og helium: Disse elementer har kun brug for 2 elektroner for at opnå en fuld ydre skal.
Sammenfattende gør en fuld oktet et atom meget stabilt og ureaktivt, da det allerede har en komplet ydre elektronskal, svarende til de ædle gasser.
Sidste artikelHvad er den første kondensfase?
Næste artikelHvad er bølgelængderne af brint?
 Varme artikler
Varme artikler
-
 Efter mere end et årti, ChIP-seq kan trods alt være kvantitativKredit:Unsplash/CC0 Public Domain I mere end et årti, forskere, der studerer epigenetik, har brugt en kraftfuld metode kaldet ChIP-seq til at kortlægge ændringer i proteiner og andre kritiske regu
Efter mere end et årti, ChIP-seq kan trods alt være kvantitativKredit:Unsplash/CC0 Public Domain I mere end et årti, forskere, der studerer epigenetik, har brugt en kraftfuld metode kaldet ChIP-seq til at kortlægge ændringer i proteiner og andre kritiske regu -
 Oxidsintring ved lufttrykskontrolOpstilling af en prøve i en lufttryksreguleringsatmosfæreovn. Kredit:Toyohashi University of Technology Professor Hiromi Nakano fra Toyohashi University of Technology har samarbejdet med en virkso
Oxidsintring ved lufttrykskontrolOpstilling af en prøve i en lufttryksreguleringsatmosfæreovn. Kredit:Toyohashi University of Technology Professor Hiromi Nakano fra Toyohashi University of Technology har samarbejdet med en virkso -
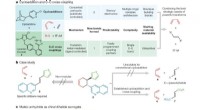 Det bedste fra begge verdener:Kombination af to skeletopbyggende kemiske reaktioneren, Sammenligning af cycloaddition og C-C krydskobling. Bu, butyl; R–X, elektrofil; R′–M, nukleofil. b, Casestudie:retrosyntetisk analyse af enantiopren byggesten 3. Denne byggesten kunne i teorien da
Det bedste fra begge verdener:Kombination af to skeletopbyggende kemiske reaktioneren, Sammenligning af cycloaddition og C-C krydskobling. Bu, butyl; R–X, elektrofil; R′–M, nukleofil. b, Casestudie:retrosyntetisk analyse af enantiopren byggesten 3. Denne byggesten kunne i teorien da -
 Infrarød sensor fungerer som et nyt værktøj til opdagelse af lægemidlerKredit:Sisacom, Shutterstock Forskere har fundet en ny metode til at analysere, hvordan aktive midler påvirker et specifikt protein, der er vigtigt for celleoverlevelse. Deres forskning kan hjælpe
Infrarød sensor fungerer som et nyt værktøj til opdagelse af lægemidlerKredit:Sisacom, Shutterstock Forskere har fundet en ny metode til at analysere, hvordan aktive midler påvirker et specifikt protein, der er vigtigt for celleoverlevelse. Deres forskning kan hjælpe
- Hvilket instrument bruges til at måle gennemsnitlig kinetisk energi i et stof?
- Faldende bibestande:Et naturligt fænomen eller en advarsel?
- Yderligere arktiske vejrdata øger prognosenøjagtigheden af Japans kolde bølger
- Hvornår uddøde dinosaurerne? Teorierne om, hvordan det skete, og hvad der overlevede
- Hvad er energikonverteringerne af en pære?
- Ulemperne ved dyr, der bor i grupper


