Var Rutherfords model af Atomet forkert eller ufuldstændig?
hvad Rutherfords model fik ret:
* kerne: Han identificerede korrekt eksistensen af en tæt, positivt ladet kerne i midten af atomet.
* Elektroner: Han foreslog, at negativt ladede elektroner kredser om kernen som planeter omkring solen.
hvad Rutherfords model gik glip af:
* Elektronenerginiveau: Rutherfords model forklarede ikke, hvorfor elektroner ikke spiralede ind i kernen på grund af deres konstante acceleration. Dette problem blev behandlet af Bohrs model, der introducerede konceptet med kvantiseret energiniveau.
* Elektroner: Rutherfords model behandlede elektroner som klassiske partikler. Elektroner udviser imidlertid bølglignende egenskaber, og deres opførsel styres af kvantemekanik.
* atomspektre: Rutherfords model kunne ikke forklare de specifikke frekvenser af lys, der udsendes og absorberes af atomer, et fænomen kendt som atomspektre. Dette blev forklaret med Bohrs model og videreudviklet af den kvantemekaniske model.
Kortfattet:
Rutherfords model var en banebrydende opdagelse, der revolutionerede vores forståelse af atomet. Det var dog ufuldstændigt. Efterfølgende udviklinger, især Niels Bohrs arbejde og udvikling af kvantemekanik, gav et mere nøjagtigt og omfattende billede af atomstruktur.
 Varme artikler
Varme artikler
-
 Vegetabilske proteiner erstatter petroleumsbaserede råvarerRapsmark i blomst:Raps er det mest dyrkede oliefrø i Tyskland – det er på tredjepladsen på verdensplan efter oliepalme og soja. Kredit:Alexas_Fotos/pixabay.com Ligesom cellulose, lignin og fedtsto
Vegetabilske proteiner erstatter petroleumsbaserede råvarerRapsmark i blomst:Raps er det mest dyrkede oliefrø i Tyskland – det er på tredjepladsen på verdensplan efter oliepalme og soja. Kredit:Alexas_Fotos/pixabay.com Ligesom cellulose, lignin og fedtsto -
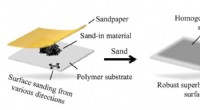 Vand kan ikke røre ved denne slibede, pulveriserede overfladeEn illustration viser sand-in-teknikken udviklet hos Rice til at gøre materialer superhydrofobe. Et-trinsmetoden, der involverer sandpapir og pulver, giver også materialer forbedrede anti-isningsegens
Vand kan ikke røre ved denne slibede, pulveriserede overfladeEn illustration viser sand-in-teknikken udviklet hos Rice til at gøre materialer superhydrofobe. Et-trinsmetoden, der involverer sandpapir og pulver, giver også materialer forbedrede anti-isningsegens -
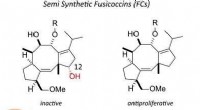 Redigeret plantebaseret toksin besidder antitumoregenskaberFusicoccin, et fytotoksin, blev omdannet til en række antiproliferative midler til tumorceller ved at fjerne 12-hydroxylgruppen. Disse forbindelser blev vist at opregulere interaktion mellem 1433 og e
Redigeret plantebaseret toksin besidder antitumoregenskaberFusicoccin, et fytotoksin, blev omdannet til en række antiproliferative midler til tumorceller ved at fjerne 12-hydroxylgruppen. Disse forbindelser blev vist at opregulere interaktion mellem 1433 og e -
 Forskere udvikler ultrahøjtydende plasmoniske metaloxidmaterialerKredit:CC0 Public Domain I en undersøgelse offentliggjort i Avancerede materialer , forskere fra Hefei National Laboratory for Physical Sciences på Microscale, University of Science and Technolo
Forskere udvikler ultrahøjtydende plasmoniske metaloxidmaterialerKredit:CC0 Public Domain I en undersøgelse offentliggjort i Avancerede materialer , forskere fra Hefei National Laboratory for Physical Sciences på Microscale, University of Science and Technolo
- Hvad er årsagen til laksens migrationsmønstre?
- For at reducere fængselspopulationer, øge mentale sundhedstjenester i lokalsamfund, tyder undersø…
- Hvad er evolutionsbedrageri?
- Hvad er videnskabelig observation?
- Lavet i Fukushima:Japanske landmænd kæmper for at vinde tillid
- Hvilke to faktorer får en tåge til at udvikle sig til stjerne?


