Hvad er forskellene i bevægelser og arrangementer partikler faste væsker?
faste stoffer
* Arrangement: Partikler er tæt pakket i et regelmæssigt, gentagende mønster (krystalgitter). Denne struktur giver faste stoffer deres faste form og volumen.
* Bevægelse: Partikler vibrerer på plads, men de bevæger sig ikke frit fra deres positioner. Vibrationerne stiger med temperaturen.
væsker
* Arrangement: Partikler er tæt på hinanden, men de kan bevæge sig rundt om hinanden (mere frihed end faste stoffer). De er ikke arrangeret i et fast mønster.
* Bevægelse: Partikler bevæger sig mere frit end i faste stoffer og glider konstant forbi hinanden. Dette gør det muligt for væsker at tage formen på deres beholder, men opretholde et fast volumen.
Gasser
* Arrangement: Partikler er langt fra hinanden og har ingen fast arrangement. De bevæger sig frit i alle retninger.
* Bevægelse: Partikler bevæger sig i høje hastigheder og kolliderer med hinanden og væggene i deres beholder. Dette skaber pres.
Key Takeaways
* Afstand mellem partikler: Øges fra faste stoffer til væsker til gasser.
* Arrangement af partikler: Regelmæssig og fastgjort i faste stoffer, mindre bestilt i væsker og fuldstændig forstyrret i gasser.
* Partikelbevægelse: Vibrationer i faste stoffer, glidning i væsker og fri bevægelighed i gasser.
Tænk på det på denne måde:
* fast: Forestil dig en tæt pakket skare af mennesker, der alle står på plads, men vibrerer lidt.
* væske: Forestil dig den samme skare, men nu kan folk bevæge sig rundt om hinanden, støbe og sprænge.
* gas: Forestil dig, at mængden har spredt sig, alle bevæger sig frit i alle retninger, støder på hinanden og væggene i rummet.
Partiklernes energi spiller en afgørende rolle:
* Højere temperatur: Mere kinetisk energi, der fører til større partikelbevægelse og en tendens til at bevæge sig mod en mere forstyrret tilstand (som væske eller gas).
* lavere temperatur: Mindre kinetisk energi, der fører til langsommere partikelbevægelse og en tendens til at blive mere bestilt (som et solidt).
 Varme artikler
Varme artikler
-
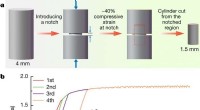 Foryngende metallisk glas for at forhindre brudForyngelse og deformation af en MG. Kredit: Natur (2020). DOI:10.1038/s41586-020-2016-3 Et team af forskere fra det kinesiske videnskabsakademi og University of Cambridge har fundet en måde at fo
Foryngende metallisk glas for at forhindre brudForyngelse og deformation af en MG. Kredit: Natur (2020). DOI:10.1038/s41586-020-2016-3 Et team af forskere fra det kinesiske videnskabsakademi og University of Cambridge har fundet en måde at fo -
 Fremstilling af snoede halvledere til 3D-projektionEn smartphone-skærm, der kan producere 3D-billeder, skal kunne vride lyset, den udsender. Nu, forskere ved University of Michigan og Ben-Gurion University i Negev har opdaget en måde at masseproducere
Fremstilling af snoede halvledere til 3D-projektionEn smartphone-skærm, der kan producere 3D-billeder, skal kunne vride lyset, den udsender. Nu, forskere ved University of Michigan og Ben-Gurion University i Negev har opdaget en måde at masseproducere -
 Yderligere to polymorfer fundet for rød-orange-gulKredit:ACS En trio af forskere ved Université de Montréal har opdaget yderligere to polymorfer for ROY, hvilket bringer det samlede antal til 10. I deres papir udgivet i Journal of the American C
Yderligere to polymorfer fundet for rød-orange-gulKredit:ACS En trio af forskere ved Université de Montréal har opdaget yderligere to polymorfer for ROY, hvilket bringer det samlede antal til 10. I deres papir udgivet i Journal of the American C -
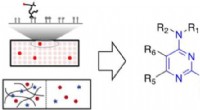 Bestemmelse af, hvad der binder til slimKredit:American Chemical Society Menneskekroppen er fuld af slim. Denne tyktflydende goo er ikke bare en gene, der bliver hostet eller nyset ud - det kan binde sig til medicin, toksiner eller mikr
Bestemmelse af, hvad der binder til slimKredit:American Chemical Society Menneskekroppen er fuld af slim. Denne tyktflydende goo er ikke bare en gene, der bliver hostet eller nyset ud - det kan binde sig til medicin, toksiner eller mikr
- Kemisk reaktion af ammoniak og HCl?
- Hvis varme overføres fra et objekt til et andet objekt. Hvilket eksempel på ved stråling?
- Sådan konverteres fotoner til Joules
- Hvad er 20D Celsius på F -skala?
- At finde manglende netværksforbindelser kan hjælpe med at udvikle nye lægemidler, stoppe sygdom, …
- Nye atmosfæriske resultater fra den internationale rumstation


