Hvordan ændrer partikler sig, som de angiver fra gas til væske?
Gasstat
* afstand: Partikler er bredt fordelt og har meget lidt interaktion med hinanden.
* Bevægelse: Partikler bevæger sig hurtigt og tilfældigt i alle retninger.
* kinetisk energi: Partikler har et højt niveau af kinetisk energi (bevægelsesenergi).
* struktur: Ingen fast form eller volumen. Gasser udvides for at fylde deres containere.
flydende tilstand
* afstand: Partikler er tættere sammen end i den gasformige tilstand.
* Bevægelse: Partikler bevæger sig langsommere og har flere interaktioner med hinanden.
* kinetisk energi: Partikler har mindre kinetisk energi end i den gasformige tilstand.
* struktur: Væsker har et bestemt volumen, men tag formen på deres beholder.
Overgangen (kondens)
1. afkøling: Når en gas afkøles, mister partiklerne kinetisk energi. De bremser ned og bevæger sig tættere sammen.
2. attraktive kræfter: Jo tættere nærhed gør det muligt for de attraktive kræfter mellem partikler at blive mere markante. Disse kræfter, som hydrogenbinding, dipol-dipol-interaktioner eller London-spredningskræfter, trækker partikler mod hinanden.
3. reduceret bevægelse: Balancen mellem kinetisk energi og attraktive kræfter skifter. Partiklerne bliver mere begrænsede, og deres bevægelse bliver mere begrænset.
4. Dannelse af en væske: Efterhånden som flere partikler kondenseres, dannes en flydende fase. Partiklerne er stadig i konstant bevægelse, men deres bevægelse er mere begrænset og koordineret end i den gasformige tilstand.
Nøglepunkter
* Energiændring: Overgangen fra gas til væske er en eksoterm proces, hvilket betyder, at varme frigøres. Den mistede kinetiske energi overføres til omgivelserne.
* Intermolekylære kræfter: Styrken af intermolekylære kræfter mellem partikler spiller en afgørende rolle i bestemmelsen af kondensationspunktet for en gas.
* reversibilitet: Processen kan vendes ved at tilføje varme (forøgelse af kinetisk energi) til væsken, hvilket får den til at fordampe og vende tilbage til den gasformige tilstand.
 Varme artikler
Varme artikler
-
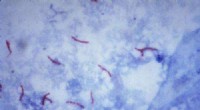 Papirbaseret tuberkulosetest kan øge diagnoser i udviklingslandeDette mikrofotografi afslører Mycobacterium tuberculosis-bakterier ved hjælp af syrefast Ziehl-Neelsen-farve; Forstørret 1000 X. De syrefaste pletter afhænger af mykobakteriers evne til at tilbagehold
Papirbaseret tuberkulosetest kan øge diagnoser i udviklingslandeDette mikrofotografi afslører Mycobacterium tuberculosis-bakterier ved hjælp af syrefast Ziehl-Neelsen-farve; Forstørret 1000 X. De syrefaste pletter afhænger af mykobakteriers evne til at tilbagehold -
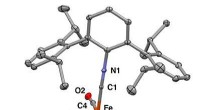 Ustabile molekyleklik med syntetisk strategiRøntgenkrystalstruktur af det mononukleære jern η2-diphosphorkompleks. Kredit:Figueroa Lab Group, UC San Diego / Curtis Moore, Ohio State University Grundstofferne i det periodiske system af grunds
Ustabile molekyleklik med syntetisk strategiRøntgenkrystalstruktur af det mononukleære jern η2-diphosphorkompleks. Kredit:Figueroa Lab Group, UC San Diego / Curtis Moore, Ohio State University Grundstofferne i det periodiske system af grunds -
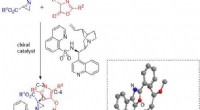 Asymmetrisk syntese af aziridin med en ny katalysator kan hjælpe med at udvikle nye lægemidlerFremstilling af aziridiner med højt udbytte og høj renhed ved hjælp af ny katalysator. Forskere fra Japan foreslog for nylig en mulig overgangstilstand for reaktionen mellem aziridiner og oxazoloner i
Asymmetrisk syntese af aziridin med en ny katalysator kan hjælpe med at udvikle nye lægemidlerFremstilling af aziridiner med højt udbytte og høj renhed ved hjælp af ny katalysator. Forskere fra Japan foreslog for nylig en mulig overgangstilstand for reaktionen mellem aziridiner og oxazoloner i -
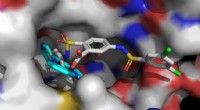 Mod udvikling af lægemidler til aldringsrelaterede sygdommeSirt6-aktivatorerne UBCS039 (cyan, foran til venstre) og MDL-801 (flerfarvet, foran til højre) er forankret i den samme bindingslomme på Sirt6. Det længere MDL-801-molekyle kontakter også tilstødende
Mod udvikling af lægemidler til aldringsrelaterede sygdommeSirt6-aktivatorerne UBCS039 (cyan, foran til venstre) og MDL-801 (flerfarvet, foran til højre) er forankret i den samme bindingslomme på Sirt6. Det længere MDL-801-molekyle kontakter også tilstødende
- Hvorfor vil folk redde regnskoven?
- Hvad bestemmer styrken af tyngdekraften mellem to objekter?
- Hvornår er solmåne og jorden i en strædet linje?
- Computermodeller afslører den bedste måde at dræbe dødelige bakterier på
- Lumens Vs. Wattage Vs. candlepower
- Hvorfor består forbindelser af metaller og nonmetals af ioner?


