Hvorfor har væsker forskellig tæthed?
1. Molekylær masse:
* Tyngre molekyler (molekyler med højere molekylvægt) pakkes generelt tættere sammen, hvilket fører til højere densitet. For eksempel har Merkur en meget højere densitet end vand, fordi dets atomer er meget tungere.
2. Molekylær struktur og binding:
* form og størrelse: Molekyler med mere komplekse former eller større størrelser pakker muligvis ikke så tæt, hvilket fører til lavere densitet.
* Intermolekylære kræfter: Stærkere intermolekylære kræfter (som brintbindinger i vand) holder molekyler tættere sammen, hvilket øger densiteten. Svagere kræfter (som Van der Waals -kræfter i kulbrinter) giver mulighed for løsere pakning, hvilket fører til lavere densitet.
3. Temperatur:
* Væsker udvides, når de opvarmes, hvilket får molekylerne til at sprede sig yderligere og mindske densiteten. Dette er grunden til, at varmt vand er mindre tæt end koldt vand.
4. Tryk:
* Stigende tryk kræfter molekyler tættere sammen, hvilket øger densiteten. Denne effekt er normalt mindre signifikant i væsker sammenlignet med gasser.
5. Sammensætning:
* Blandinger og løsninger kan have forskellige densiteter afhængigt af de relative mængder og densiteter af deres komponenter. For eksempel er saltvand tættere end rent vand, fordi saltmolekylerne tilføjer den samlede masse.
Her er nogle eksempler:
* Vand: Vand har en relativt høj densitet på grund af stærke brintbindinger mellem dets molekyler.
* Merkur: Kviksølv er meget tæt på grund af dets tunge atomer og svage intermolekylære kræfter.
* olie: Olie er mindre tæt end vand, fordi dens molekyler er større og har svagere intermolekylære kræfter, hvilket fører til løsere pakning.
At forstå disse faktorer hjælper med at forklare, hvorfor forskellige væsker har forskellige densiteter, og hvordan densitet kan bruges til at identificere og karakterisere væsker.
 Varme artikler
Varme artikler
-
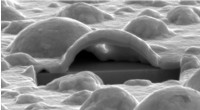 Platin danner nano-boblerElektronmikroskopudsigt ind i det indre af en platinboble. Tværsnittet blev eksponeret med en fokuseret ionstråle. Under den hule Pt-boble kan den kantede YSZ-krystal ses. Kredit:DESY, Satishkumar Kul
Platin danner nano-boblerElektronmikroskopudsigt ind i det indre af en platinboble. Tværsnittet blev eksponeret med en fokuseret ionstråle. Under den hule Pt-boble kan den kantede YSZ-krystal ses. Kredit:DESY, Satishkumar Kul -
 Superopløselig mikroskop afslører hemmeligheder ved dødbringende Nipah-virusKeng Chou (på bagsiden) og Qian Liu (forgrunden) forbereder sig på at observere en prøve ved hjælp af superopløsningsmikroskop udviklet af Chou og patenteret af UBC. Kredit:Lou Corpuz-Bosshart / UBC
Superopløselig mikroskop afslører hemmeligheder ved dødbringende Nipah-virusKeng Chou (på bagsiden) og Qian Liu (forgrunden) forbereder sig på at observere en prøve ved hjælp af superopløsningsmikroskop udviklet af Chou og patenteret af UBC. Kredit:Lou Corpuz-Bosshart / UBC -
 Partikler fra dagligdags vægmaling kan skade levende organismer, men en ny membran viser høje filt…Kredit:Ann-Kathrin Müller et al., Økotoksikologi og miljøsikkerhed (2022). DOI:10.1016/j.ecoenv.2022.113877 Dispersionsmalinger bruges mest i husholdninger til maling af vægge og lofter. Et tværfag
Partikler fra dagligdags vægmaling kan skade levende organismer, men en ny membran viser høje filt…Kredit:Ann-Kathrin Müller et al., Økotoksikologi og miljøsikkerhed (2022). DOI:10.1016/j.ecoenv.2022.113877 Dispersionsmalinger bruges mest i husholdninger til maling af vægge og lofter. Et tværfag -
 Katalyserer ammoniakdannelse ved lavere temperaturer med rutheniumMetallet ruthenium, understøttet med lanthanidoxyhydrider, kan effektivt katalysere syntesen af ammoniak ved en meget lavere temperatur end den traditionelle tilgang. Kredit:Tokyo Tech Nitrogen
Katalyserer ammoniakdannelse ved lavere temperaturer med rutheniumMetallet ruthenium, understøttet med lanthanidoxyhydrider, kan effektivt katalysere syntesen af ammoniak ved en meget lavere temperatur end den traditionelle tilgang. Kredit:Tokyo Tech Nitrogen
- Canadas energiregulator giver et nik til Pacific pipeline
- Ekspert diskuterer skaderne ved algeopblomstring
- Forskere kortlægger strømningsændringer for at måle menneskelig indvirkning på økosystemer
- Online myteforbrydere bekæmper bølgen af falske nyheder i Indien
- Betragtes det som varmeenergi at gnide hænderne sammen i en vis periode?
- Hvad kan det være et videnskabeligt spørgsmål?


