Hvordan er egenskaberne ved en gas forskellige end væske eller soild?
Gasser
* Form og volumen: Gasser har ingen fast form eller volumen. De påtager sig formen og volumenet på deres beholder. Dette skyldes, at partiklerne i en gas er langt fra hinanden og bevæger sig frit.
* Kompressibilitet: Gasser er meget komprimerbare. Du kan presse en masse gas ind i et mindre rum.
* densitet: Gasser har lave tætheder sammenlignet med væsker og faste stoffer.
* diffusion: Gasser diffunderer let. De spredte sig for at udfylde hele rummet, de besætter.
* Intermolekylære kræfter: Kræfterne til tiltrækning mellem gasmolekyler er meget svage. Dette giver dem mulighed for at bevæge sig frit og uafhængigt.
væsker
* Form og volumen: Væsker har et fast volumen, men tag formen på deres beholder. De flyder og kan hældes.
* Kompressibilitet: Væsker er meget mindre komprimerbare end gasser, men mere komprimerbare end faste stoffer.
* densitet: Væsker har højere densiteter end gasser, men lavere end faste stoffer.
* diffusion: Væsker diffunderer, men langsommere end gasser.
* Intermolekylære kræfter: Væsker har stærkere intermolekylære kræfter end gasser, men svagere end faste stoffer.
faste stoffer
* Form og volumen: Faststoffer har en fast form og volumen. De er stive og flyder ikke.
* Kompressibilitet: Faststoffer er meget vanskelige at komprimere.
* densitet: Faststoffer har de højeste tætheder af de tre stoftilstande.
* diffusion: Faststoffer diffunderer ekstremt langsomt, ofte ikke påviselig ved normale temperaturer.
* Intermolekylære kræfter: Faststoffer har de stærkeste intermolekylære kræfter. Dette holder deres partikler i en fast, stiv struktur.
En nyttig analogi:
Tænk på et klasseværelse fuld af studerende:
* gas: Studerende, der løber rundt vildt, støder på hinanden og går, hvor de vil.
* væske: Studerende, der står tæt sammen, i stand til at bevæge sig rundt, men opholder sig i klasseværelset.
* fast: Studerende, der står i en fast formation, ikke i stand til at bevæge sig meget.
Husk:
* Matterilaten afhænger af temperatur og tryk. Et stof kan ændre sin tilstand afhængigt af disse faktorer.
* Der er undtagelser fra disse generaliseringer. For eksempel kan nogle faste stoffer være ret komprimerbare, og nogle væsker kan have meget lave tætheder.
 Varme artikler
Varme artikler
-
 En bedre måde at opdele vandmolekyler for at producere brint ved hjælp af sollysTransmissionselektronmikroskopi. en, b, Valgt område-elektrondiffraktionsmønster opnået fra SrTiO3:Al ladet med Rh (0,1 vægt-%)/Cr2O3 (0,05 vægt-%)/CoOOH (0,05 vægt-%) (a) og tilsvarende transmissions
En bedre måde at opdele vandmolekyler for at producere brint ved hjælp af sollysTransmissionselektronmikroskopi. en, b, Valgt område-elektrondiffraktionsmønster opnået fra SrTiO3:Al ladet med Rh (0,1 vægt-%)/Cr2O3 (0,05 vægt-%)/CoOOH (0,05 vægt-%) (a) og tilsvarende transmissions -
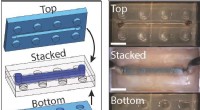 Dynamisk hydrogel bruges til at lave bløde robotkomponenter og LEGO-lignende byggeklodserLEGO-lignende hydrogel byggeklodser mønstret med bittesmå væskekanaler kan samles til komplekse mikrofluidiske enheder og derefter forsegles tæt sammen. Kredit:Wong Lab / Brown University Ved at b
Dynamisk hydrogel bruges til at lave bløde robotkomponenter og LEGO-lignende byggeklodserLEGO-lignende hydrogel byggeklodser mønstret med bittesmå væskekanaler kan samles til komplekse mikrofluidiske enheder og derefter forsegles tæt sammen. Kredit:Wong Lab / Brown University Ved at b -
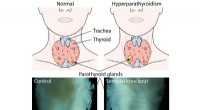 Opdagelse af signalprotein kan føre til lægemiddelbaserede terapier til behandling af hyperparathy…Fire små biskjoldbruskkirtler placeret i nakken bag den større skjoldbruskkirtel er ansvarlige for at styre sunde blodcalciumniveauer. Primær hyperparatyreoidisme er præget af overdreven parathyreoide
Opdagelse af signalprotein kan føre til lægemiddelbaserede terapier til behandling af hyperparathy…Fire små biskjoldbruskkirtler placeret i nakken bag den større skjoldbruskkirtel er ansvarlige for at styre sunde blodcalciumniveauer. Primær hyperparatyreoidisme er præget af overdreven parathyreoide -
 Forskere afslører en skjult forbindelse med calciumkolesterolMarek Michalak, en professor ved University of Albertas Department of Biochemistry og kandidatstuderende Wen-An Wang var en del af holdet, der opdagede en direkte sammenhæng mellem calcium og kolester
Forskere afslører en skjult forbindelse med calciumkolesterolMarek Michalak, en professor ved University of Albertas Department of Biochemistry og kandidatstuderende Wen-An Wang var en del af holdet, der opdagede en direkte sammenhæng mellem calcium og kolester
- Israelsk højteknologi ser fremad-hvem der vinder stemmer
- Hvem deltager i NCAA-turneringen? Forskere ved University of Illinois kan hjælpe
- Hvorfor kaldes massive stjerner elementfabrikker?
- Kulturelle og sproglige netværk af centralafrikanske jæger-samlere har gammel oprindelse, viser un…
- Hvad har elementerne calciumkobber og brom alle til fælles?
- Hvad er det interplanetære materiale, der brænder op og bliver en lys glødende lysstribe i atmosf…


