Hvordan bestemmer du valenselektroner ved hjælp af orbitaldiagram?
1. Forstå det grundlæggende:
* Valenselektroner: Dette er elektronerne i det yderste energiniveau af et atom. Det er dem, der er involveret i kemisk binding.
* orbital diagram: En visuel repræsentation af, hvordan elektroner distribueres inden for de forskellige energiniveauer og underniveauer af et atom. Hver boks repræsenterer en atomisk orbital, og pile i kasserne repræsenterer elektroner.
2. Følg disse trin:
1. Skriv elektronkonfigurationen: Start med at skrive elementets elektronkonfiguration. For eksempel er Carbon's elektronkonfiguration 1S² 2S² 2p².
2. Tegn orbitalerne: Tegn orbitalerne for det højeste energiniveau. I kulstofeksemplet er dette det 2. energiniveau. Tegn en boks til hver orbital:
* For S--Sublet skal du tegne en boks (1 orbital).
* Til P-SUBLEVEL skal du tegne tre kasser (3 orbitaler).
3. Fyld orbitaler: Fyld orbitalerne med elektroner i henhold til Hunds regel og Pauli -ekskluderingsprincippet:
* Hunds regel: Placer en elektron i hver orbital inden for et under niveau, inden du parrer elektroner i den samme orbital.
* Pauli Ekskluderingsprincip: Hver orbital kan maksimalt holde to elektroner, og disse elektroner skal have modsatte spins (repræsenteret ved pile, der peger op og ned).
4. Identificer valenselektroner: Elektronerne i det højeste energiniveau er valenselektronerne. I carboneksemplet repræsenterer 2S² 2p² valenselektronerne (i alt 4).
Eksempel:Oxygen
1. Elektronkonfiguration: 1S² 2S² 2P⁴
2. orbital diagram:
* 2S:↑ ↓
* 2p:↑ ↓ ↑ ↑
3. Valenselektroner: Oxygen har 6 valenselektroner (2 i 2'erne orbital og 4 i 2p orbitaler).
Vigtig note: Overgangsmetaller kan have forskellige valenselektronoptællinger på grund af involvering af D-orbitaler. Deres orbitaldiagrammer kan blive mere komplekse.
 Varme artikler
Varme artikler
-
 Ramanome-databasen kan hjælpe med at udvinde mikroalgecellefabrikker for at reducere kulstofemissio…Maskinindlæring af ramanomer hjælper med at screene mikroalgalcellefabrikker, der reparerer kuldioxid. Kredit:LIU Yang Mikroalger er simple organismer af enkeltceller, Alligevel giver de et stort
Ramanome-databasen kan hjælpe med at udvinde mikroalgecellefabrikker for at reducere kulstofemissio…Maskinindlæring af ramanomer hjælper med at screene mikroalgalcellefabrikker, der reparerer kuldioxid. Kredit:LIU Yang Mikroalger er simple organismer af enkeltceller, Alligevel giver de et stort -
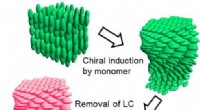 Metode til at skabe optisk aktive polymerer ved hjælp af en spiralformet flydende krystalskabelonGrafisk abstrakt. Kredit:Molekylære krystaller og flydende krystaller (2022). DOI:10.1080/15421406.2022.2073421 En videnskabsmand fra Fakultetet for Rene og Anvendte Videnskaber ved University of T
Metode til at skabe optisk aktive polymerer ved hjælp af en spiralformet flydende krystalskabelonGrafisk abstrakt. Kredit:Molekylære krystaller og flydende krystaller (2022). DOI:10.1080/15421406.2022.2073421 En videnskabsmand fra Fakultetet for Rene og Anvendte Videnskaber ved University of T -
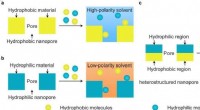 Effektiv glycopeptidseparation opnået ved grænseflade polymeriserede polymerpartiklera) Konventionelle hydrofobe porøse materialer. b) Konventionelle hydrofile porøse materialer. c) Porøse materialer med hydrofile-hydrofobe heterostrukturerede nanoporer. Kredit:Dr. SONG Yongyang K
Effektiv glycopeptidseparation opnået ved grænseflade polymeriserede polymerpartiklera) Konventionelle hydrofobe porøse materialer. b) Konventionelle hydrofile porøse materialer. c) Porøse materialer med hydrofile-hydrofobe heterostrukturerede nanoporer. Kredit:Dr. SONG Yongyang K -
 Sådan klæber du sensorer til huden uden klæbemiddelKredit:Binghamton University Forestil dig, hvis du kunne sætte noget på din hud uden at have brug for lim. En biosensor, et ur, en kommunikationsenhed, et modetilbehør – mulighederne er uendelige.
Sådan klæber du sensorer til huden uden klæbemiddelKredit:Binghamton University Forestil dig, hvis du kunne sætte noget på din hud uden at have brug for lim. En biosensor, et ur, en kommunikationsenhed, et modetilbehør – mulighederne er uendelige.
- Hvad er den typiske linjespænding til en bolig ved hjælp af elektrisk varme?
- Hvordan ændrede Albert -teori om relativitet loven, hvis bevaringsenergi?
- Bevaringsnedskæringer bringer Brasiliens Amazon-dyr i fare
- Alt, der glimter, er ikke guld:Misbrug af kunstig intelligens af stor teknologi kan skade udviklings…
- EXPLAINER:Hvad er en derecho?
- Lækager viser koncernens klimaindsats


