Hvad er tætheden af ædelgasser?
Ved standardtemperatur og tryk (STP):
* helium (He): 0,1785 g/l
* neon (NE): 0,9002 g/l
* argon (AR): 1,784 g/l
* krypton (KR): 3,733 g/l
* Xenon (XE): 5,894 g/l
* radon (RN): 9,73 g/l
Nøglepunkter:
* densitet øges ned i gruppen: Når du bevæger dig ned i gruppen af ædle gasser (fra helium til radon), øges atommassen, hvilket fører til højere densiteter.
* Effekt af temperatur og tryk: Densitet er også påvirket af temperatur og tryk. Højere tryk fører til højere densitet, mens højere temperatur fører til lavere densitet.
Hvorfor er ædle gasser mindre tætte end andre elementer?
Noble gasser er monatomiske, hvilket betyder, at de findes som individuelle atomer snarere end molekyler. De er også meget ureaktive på grund af deres fulde valenselektronskaller. Denne mangel på binding resulterer i:
* Stor atomafstand: Noble gasatomer er langt fra hinanden, hvilket fører til lavere masse pr. Enhedsvolumen.
* svage interatomiske kræfter: De svage van der Waals -styrker mellem ædle gasatomer bidrager til deres lave densitet.
Anvendelser af ædelgasdensitet:
* heliumballoner: Den lave tæthed af helium gør det muligt at bruge det til fyldning af balloner og luftskibe.
* ARC -svejsning: Argonens høje tæthed gør det til en passende afskærmningsgas til lysbuesvejsning.
* belysning: Neonskilte bruger den karakteristiske glød af neongas, mens andre ædelgasser bruges i forskellige typer belysning.
Bemærk: De leverede densitetsværdier er for STP -betingelser. For nøjagtige densitetsberegninger under forskellige forhold, skal du bruge den ideelle gaslov eller mere komplekse tilstandsligninger.
Sidste artikelHar et krystallinsk fast stof en bestemt form?
Næste artikelHvad er elektronkonfigurationen af aluminium?
 Varme artikler
Varme artikler
-
 Ny måde at reducere ardannelser i huden er afhængig af et limlignende stof, der udskilles af musli…Perna viridis muslinger. Kredit:Wikipedia (Phys.org) – Et team af forskere ved Pohang University of Science and Technology i Sydkorea har udviklet en ny hudapplikation designet til at reducere ard
Ny måde at reducere ardannelser i huden er afhængig af et limlignende stof, der udskilles af musli…Perna viridis muslinger. Kredit:Wikipedia (Phys.org) – Et team af forskere ved Pohang University of Science and Technology i Sydkorea har udviklet en ny hudapplikation designet til at reducere ard -
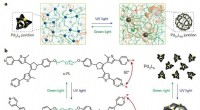 Lysstyrede polymerer kan skifte mellem robuste og blødeDesign af polyMOCer med fotoskiftbar topologi. Kredit:(c) Natur (2018). DOI:10.1038/s41586-018-0339-0 MIT -forskere har designet et polymermateriale, der kan ændre dets struktur som reaktion på
Lysstyrede polymerer kan skifte mellem robuste og blødeDesign af polyMOCer med fotoskiftbar topologi. Kredit:(c) Natur (2018). DOI:10.1038/s41586-018-0339-0 MIT -forskere har designet et polymermateriale, der kan ændre dets struktur som reaktion på -
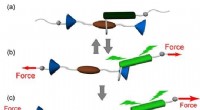 Nysgerrige sammenlåste molekyler viser dobbelt responsFigur 1. Skematisk illustration af driften af en rotaxan-baseret mekanophor, viser (a) kraftfri tilstand, (b) reversibel, og (c) irreversible svar. Forskere udforskede en mærkelig sammenkoblet molek
Nysgerrige sammenlåste molekyler viser dobbelt responsFigur 1. Skematisk illustration af driften af en rotaxan-baseret mekanophor, viser (a) kraftfri tilstand, (b) reversibel, og (c) irreversible svar. Forskere udforskede en mærkelig sammenkoblet molek -
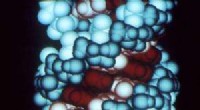 Hvordan RNA blev dannet ved livets oprindelseDette er en computergrafik af et RNA-molekyle. Kredit:Richard Feldmann/Wikipedia En enkelt proces for, hvordan en gruppe af molekyler kaldet nukleotider blev lavet på den tidlige Jord, før livet b
Hvordan RNA blev dannet ved livets oprindelseDette er en computergrafik af et RNA-molekyle. Kredit:Richard Feldmann/Wikipedia En enkelt proces for, hvordan en gruppe af molekyler kaldet nukleotider blev lavet på den tidlige Jord, før livet b
- Spor i klipper fortæller os, hvor gamle dyr strejfede i det sydlige Afrika
- Hvad er et stykke jord omgivet af vand på to sider?
- Sådan Find Mass From Density
- Brydebølger og fugttransport driver ekstreme nedbørshændelser
- Hvad er den største åbne pit -mine i verden, og den ligger?
- Undersøgelse afslører en ny måde at forbedre eller reducere vedhæftningen af frysende dråber


