Når jern reagerer med ilt for at danne rust hvert atom?
Processen:
1. jern (Fe) atomer: Jernatomer har en tendens til at miste elektroner, hvilket gør dem reaktive. De har en metallisk binding, hvilket betyder, at deres ydre elektroner holdes løst.
2. ilt (O2) molekyler: Oxygenmolekyler er meget stabile, men de kan let acceptere elektroner.
3. Oxidation: Når jern udsættes for ilt og fugt (vand), forekommer en kemisk reaktion kaldet oxidation.
* Jernatomer mister elektroner (de bliver oxideret) for at danne jernioner (fe²⁺ eller fe³⁺).
* Oxygenmolekyler får elektroner (de bliver reduceret) for at danne oxidioner (O²⁻).
4. Rustformation: Jernionerne (Fe²⁺ eller Fe³⁺) og oxidioner (O²⁻) kombineres med vandmolekyler for at danne hydratiserede jernoxider. Disse oxider er almindeligt kendt som rust. Den kemiske formel for rust er kompleks, men den er normalt repræsenteret som fe₂o₃ · xh₂o.
Nøglepunkter:
* Elektronoverførsel: Nøglen til rustdannelse er overførsel af elektroner fra jernatomer til iltmolekyler.
* Korrosion: Rusting er en form for korrosion, en proces, der svækker og forringer metaller.
* fugt: Fugt (vand) er afgørende for rustning. Vand fungerer som et opløsningsmiddel og giver ionerne mulighed for at bevæge sig rundt og kombinere.
forenklet forklaring:
Tænk på det sådan:
* Jern ønsker at give væk elektroner.
* Oxygen ønsker at tage elektroner.
* Når de mødes i nærvær af vand, sker udvekslingen og rustformer.
Fortæl mig, hvis du gerne vil lære mere om specifikke typer rust eller hvordan man forhindrer rustning!
Sidste artikelNår et stof er i en blanding, hvad holder hver, hver?
Næste artikelHvilke materialer er god dirigent?
 Varme artikler
Varme artikler
-
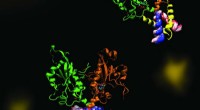 En molekylær dans af fosfolipidsynteseCCT er et nøgleenzym, der opretholder en afbalanceret sammensætning af cellemembranfosfolipider. Billedet fremhæver dynamikken i en del af enzymet CCT, der er afgørende for regulering af dets funktion
En molekylær dans af fosfolipidsynteseCCT er et nøgleenzym, der opretholder en afbalanceret sammensætning af cellemembranfosfolipider. Billedet fremhæver dynamikken i en del af enzymet CCT, der er afgørende for regulering af dets funktion -
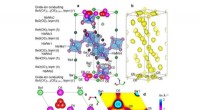 Nye materialer med høj ilt-ion-ledningsevne åbner en bæredygtig fremtidEksperimentelt bevis for den interstitielle oxygen O5 og O1-O5 oxid-ion-interstitialitet diffusion af Ba7Nb3.9Mo1.1O20.05 ved en høj temperatur på 800 oC. Kredit:Tokyo Institute of Technology Fors
Nye materialer med høj ilt-ion-ledningsevne åbner en bæredygtig fremtidEksperimentelt bevis for den interstitielle oxygen O5 og O1-O5 oxid-ion-interstitialitet diffusion af Ba7Nb3.9Mo1.1O20.05 ved en høj temperatur på 800 oC. Kredit:Tokyo Institute of Technology Fors -
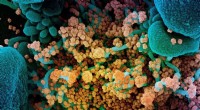 Forskere opdager SARS-CoV-2-hæmmereFarvelagt scanningselektronmikrofotografi af en døende celle (blå) stærkt inficeret med SARS-CoV-2 (gul), virus, der forårsager COVID-19. Kredit:NIAID Integrated Research Facility, Fort Detrick, Maryl
Forskere opdager SARS-CoV-2-hæmmereFarvelagt scanningselektronmikrofotografi af en døende celle (blå) stærkt inficeret med SARS-CoV-2 (gul), virus, der forårsager COVID-19. Kredit:NIAID Integrated Research Facility, Fort Detrick, Maryl -
 Forskere udvikler overfladesyre- og selektivitetsjusterbar manganoxidkatalysatorKredit:CC0 Public Domain En forskergruppe ledet af prof. Xu Jie fra Dalian Institute of Chemical Physics (DICP) under det kinesiske videnskabsakademi har udviklet en overfladesurheds- og selektivi
Forskere udvikler overfladesyre- og selektivitetsjusterbar manganoxidkatalysatorKredit:CC0 Public Domain En forskergruppe ledet af prof. Xu Jie fra Dalian Institute of Chemical Physics (DICP) under det kinesiske videnskabsakademi har udviklet en overfladesurheds- og selektivi
- Laserteknologi giver et gennembrud til at opdage ulovligt elfenben
- Hvad er transformationen af en eksisterende klippe på grund af høj varme og pres?
- Hvorfor foretog Aristarchus sine målinger af Suns -afstand på tiden en halvmåne?
- Hvor i bladet er lysenergi, der er fanget?
- Quartzite bliver til den stødende klippe?
- En skudsikker varmepude


