Hvorfor gas ikke har noget bestemt volumen?
* Partikelafstand: Gasmolekyler er langt fra hinanden sammenlignet med væsker og faste stoffer. De har svage intermolekylære kræfter, så de kan bevæge sig frit og uafhængigt.
* kinetisk energi: Gasmolekyler har høj kinetisk energi, bevæger sig konstant og kolliderer med hinanden og væggene i deres beholder.
* Kompressibilitet: På grund af de store rum mellem molekyler kan gas let komprimeres. Når der påføres tryk, tvinges molekylerne tættere sammen, hvilket reducerer det samlede volumen.
Eksempel: Forestil dig en ballon. Når du blæser luft ind i den, fylder gasmolekylerne hele rummet i ballonen. Hvis du klemmer ballonen, komprimeres gasmolekylerne, og ballonens volumen falder.
Kortfattet:
* Gasmolekyler fastgøres ikke i et specifikt arrangement, i modsætning til faste stoffer og væsker.
* De kan udvide til at fylde hele volumenet på deres beholder på grund af deres høje kinetiske energi og svage intermolekylære kræfter.
* Mens gas kan komprimeres, betyder det ikke, at det ikke har noget volumen, bare at volumen ikke er fast og kan ændres afhængigt af trykket og temperaturen.
 Varme artikler
Varme artikler
-
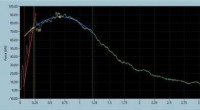 NIST-software hjælper med analysen af instrumenterede charpy-testsEt skærmbillede fra NICAS, viser en instrumenteret kraft/forskydningskurve for en fuldt duktilt prøve og dens tilsvarende karakteristiske kraftparametre (generelt udbytte, maksimal kraft, slutningen a
NIST-software hjælper med analysen af instrumenterede charpy-testsEt skærmbillede fra NICAS, viser en instrumenteret kraft/forskydningskurve for en fuldt duktilt prøve og dens tilsvarende karakteristiske kraftparametre (generelt udbytte, maksimal kraft, slutningen a -
 Planteforskere undersøger brødaroma:Moderne og gamle hvedesorter smager lige godtIdentiske opskrifter blev brugt til at bage brød fra forskellige hvedesorter, som derefter blev prøvet. Allerede det ydre udseende af hvert af brødene varierer betydeligt. Kredit:BeckaBeck Hvede e
Planteforskere undersøger brødaroma:Moderne og gamle hvedesorter smager lige godtIdentiske opskrifter blev brugt til at bage brød fra forskellige hvedesorter, som derefter blev prøvet. Allerede det ydre udseende af hvert af brødene varierer betydeligt. Kredit:BeckaBeck Hvede e -
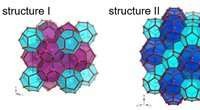 Neutroner afslører hurtig metan -translationel diffusion ved grænsefladen mellem to klathratstrukt…Enhedsceller af clathratstruktur I og clathrate -struktur II. Forskellige typer polyhedrale bure er repræsenteret i forskellige farver. Kredit:Ranieri et al., Nature Comm . Gasclathrat-hydrater
Neutroner afslører hurtig metan -translationel diffusion ved grænsefladen mellem to klathratstrukt…Enhedsceller af clathratstruktur I og clathrate -struktur II. Forskellige typer polyhedrale bure er repræsenteret i forskellige farver. Kredit:Ranieri et al., Nature Comm . Gasclathrat-hydrater -
 Mini-protein hurtig designmetode åbner vejen for at skabe en ny klasse af lægemidlerKunstnerindtryk af computerdesignede miniproteinbindere rettet mod influenzahæmagglutinin. Mange binder og neutraliserer effektivt virussen. Kredit:Cognition Studio Seattle, Daniel-Adriano Silva og La
Mini-protein hurtig designmetode åbner vejen for at skabe en ny klasse af lægemidlerKunstnerindtryk af computerdesignede miniproteinbindere rettet mod influenzahæmagglutinin. Mange binder og neutraliserer effektivt virussen. Kredit:Cognition Studio Seattle, Daniel-Adriano Silva og La


