Hvad sker der med volumenet af en gas, hvis dens temperatur reduceres med 25 procent?
Charles 'lov
Charles 'lov siger, at volumenet af en ideel gas er direkte proportional med dens absolutte temperatur under forudsætning af, at trykket forbliver konstant. Matematisk:
* V₁/t₁ =v₂/t₂
Hvor:
* V₁ =indledende bind
* T₁ =indledende absolut temperatur (i Kelvin)
* V₂ =slutvolumen
* T₂ =endelig absolut temperatur (i Kelvin)
Problemet:
* Temperaturreduktion: En 25% reduktion i temperaturen er relativ. Hvis den oprindelige temperatur er 100 kelvin, er en reduktion på 25% 25 Kelvin, hvilket bringer den endelige temperatur til 75 Kelvin.
* absolut temperatur: Charles 'lov arbejder med absolut temperatur (Kelvin). En reduktion på 25% i Celsius eller Fahrenheit oversætter ikke direkte til en 25% reduktion i Kelvin.
Eksempel:
Lad os sige, at den oprindelige temperatur på gassen er 100 kelvin, og vi reducerer den med 25% til 75 Kelvin. Vi kan bruge Charles lov til at finde ændringen i volumen:
* V₁/100 =V₂/75
* V₂ =(75/100) * V₁
* V₂ =0,75 * V₁
Dette betyder, at volumenet falder med 25%.
Konklusion:
En reduktion på 25% i temperatur er ikke altid føre til en 25% reduktion i volumen. Den faktiske ændring i volumen afhænger af den oprindelige temperatur og den specifikke gas. Du skal kende den oprindelige temperatur (i Kelvin) og den endelige temperatur (efter 25% reduktion) for at beregne ændringen i volumen.
Sidste artikelHvad er tre stoffer fra mest tæt til mindst tæt?
Næste artikelHvordan passerer faste stoffer gennem væsker?
 Varme artikler
Varme artikler
-
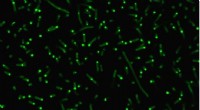 Forskere skaber kunstige organeller for at kontrollere cellulær adfærdIntrinsisk forstyrrede proteiner (fluorescerende grønt) klumper sig sammen i celler for at danne kunstige organeller. Kredit:Duke University Biomedicinske ingeniører ved Duke University har demons
Forskere skaber kunstige organeller for at kontrollere cellulær adfærdIntrinsisk forstyrrede proteiner (fluorescerende grønt) klumper sig sammen i celler for at danne kunstige organeller. Kredit:Duke University Biomedicinske ingeniører ved Duke University har demons -
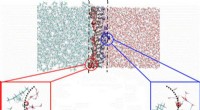 Toppe af vandige bølger kan transportere vitale kemikalier i industriel separationsprocesHvordan molekyler bevæger sig og organiserer sig i vand, når væsken møder olien, afhænger af, om kemikaliet er på toppen eller truget af en lille bølge af vand ved grænsefladen. Kredit:US Department o
Toppe af vandige bølger kan transportere vitale kemikalier i industriel separationsprocesHvordan molekyler bevæger sig og organiserer sig i vand, når væsken møder olien, afhænger af, om kemikaliet er på toppen eller truget af en lille bølge af vand ved grænsefladen. Kredit:US Department o -
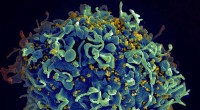 Når HIV-medicin ikke samarbejderHIV inficerer en menneskelig celle. Kredit:NIH Udtrykket synergi har fået et ry som et overbrugt buzzword, men det har en kvantificerbar definition i farmakologi. To lægemidler anses for synergist
Når HIV-medicin ikke samarbejderHIV inficerer en menneskelig celle. Kredit:NIH Udtrykket synergi har fået et ry som et overbrugt buzzword, men det har en kvantificerbar definition i farmakologi. To lægemidler anses for synergist -
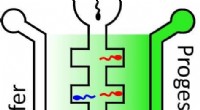 En ny måde at vurdere mandlig fertilitet påMere sædceller bevæger sig til højre side af en central kanal, som indeholder høje koncentrationer af progesteron (mørkegrøn), end til venstre side, som indeholder lavere koncentrationer (lysegrøn). K
En ny måde at vurdere mandlig fertilitet påMere sædceller bevæger sig til højre side af en central kanal, som indeholder høje koncentrationer af progesteron (mørkegrøn), end til venstre side, som indeholder lavere koncentrationer (lysegrøn). K
- Nigerianske bagerier har brug for støtte til at skifte til ren energi, siger forskere
- Undersøgelse peger på, hvordan hudcellers identitet kan skilles ad for at skabe stamceller
- COVID-19:Halvdelen af britiske husholdninger tror, de vil kæmpe for at opfylde deres økonomisk…
- Hvorfor får Jorden mere energi fra solen end alle andre stjerner i universet kombineret?
- Brint kan være nøglen til vækst af grafen af høj kvalitet
- Hvilken rolle i indsnævring i et termometer?


