Hvilket symbol i den første lov om termodynamik repræsenterer et resultatgas, der ekspanderer mod konstant pres?
Her er hvorfor:
* første lov om termodynamik: ΔU =Q + W
* ΔU:Ændring i systemets intern energi
* Q:Varme tilsat til systemet
* W:arbejde udført af systemet
* arbejde udført ved at udvide gas: Når en gas udvides mod et konstant tryk, fungerer den på omgivelserne. Det udførte arbejde (W) beregnes som:
* W =-pδv
* P:Konstant pres
* ΔV:Ændring i volumen
Vigtige noter:
* Det udførte arbejde er negativt Fordi systemet (gas) arbejder på omgivelserne.
* Den første lov om termodynamik hedder, at ændringen i intern energi er lig med varmen tilføjet minus det arbejde, der er udført af systemet.
* Hvis gassen komprimeres (volumen falder), er det udførte arbejde positivt, da omgivelserne udfører arbejde på systemet.
Fortæl mig, hvis du gerne vil have mere afklaring på ethvert aspekt af den første lov om termodynamik!
 Varme artikler
Varme artikler
-
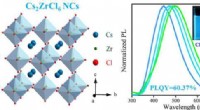 Forskere syntetiserer blyfrit zirkoniumbaseret ledigt bestilt dobbelt perovskit-nanokrystallerBlyfri perovskit Cs2ZrCl6 NCer med en PLQY op til 60,37% syntetiseres. Kredit:LIU Siping og YANG Bin I de seneste år, uorganisk CsPbX 3 (X =Cl, Br, I) peranovskite -nanokrystaller har tiltrukket
Forskere syntetiserer blyfrit zirkoniumbaseret ledigt bestilt dobbelt perovskit-nanokrystallerBlyfri perovskit Cs2ZrCl6 NCer med en PLQY op til 60,37% syntetiseres. Kredit:LIU Siping og YANG Bin I de seneste år, uorganisk CsPbX 3 (X =Cl, Br, I) peranovskite -nanokrystaller har tiltrukket -
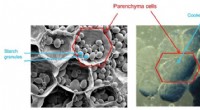 Ny forarbejdningsteknik kan gøre kartofler sundereMikroskopisk billede af kartoffelvæv før (venstre) og efter (højre) kogning eller forarbejdning. Kredit:Amy Lin, A*STAR, og Yijing Shao og YuLian Lin, University of Idaho. Forskere annoncerede tidl
Ny forarbejdningsteknik kan gøre kartofler sundereMikroskopisk billede af kartoffelvæv før (venstre) og efter (højre) kogning eller forarbejdning. Kredit:Amy Lin, A*STAR, og Yijing Shao og YuLian Lin, University of Idaho. Forskere annoncerede tidl -
 Væske-væske-overgange krystalliserer nye ideer til molekylære væskerKredit:CC0 Public Domain Krystallisation beskriver dannelsen af ordnede strukturer fra de uordnede bestanddele af en væske. Selvom den grundlæggende teori om krystaldannelse er blevet bredt unde
Væske-væske-overgange krystalliserer nye ideer til molekylære væskerKredit:CC0 Public Domain Krystallisation beskriver dannelsen af ordnede strukturer fra de uordnede bestanddele af en væske. Selvom den grundlæggende teori om krystaldannelse er blevet bredt unde -
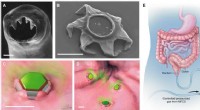 Gastrointestinal-resident, formskiftende mikrodele til forlænget lægemiddeltilførselFormskiftende behandlere som selvlåsende medicinleveringsenheder. (A) Scanning elektronmikroskopi (SEM) billede af ventrikeltænderne på hookworm A. duodenale. Ormen bruger disse skarpe tænder til at t
Gastrointestinal-resident, formskiftende mikrodele til forlænget lægemiddeltilførselFormskiftende behandlere som selvlåsende medicinleveringsenheder. (A) Scanning elektronmikroskopi (SEM) billede af ventrikeltænderne på hookworm A. duodenale. Ormen bruger disse skarpe tænder til at t
- Når kroppen falder frit mod Jorden, så er dens samlede energi?
- Forskere forbedrer den nanopore-baserede teknologi til påvisning af DNA-molekyler
- Hvad er små dråber væske ophængt i luften fra?
- Vil ammoniumchlorid blive betragtet som opløseligt i vand?
- Hvordan opstod Dimorphos?
- Hvad er urinens pH i en dehydreret person?


