Hvordan påvirker tætheden af en væske dens kogepunkt?
Her er hvorfor:
* kogepunkt bestemmes af styrken af intermolekylære kræfter. Jo stærkere kræfter, der holder molekyler sammen (som brintbindinger, dipol-dipolinteraktioner eller London-spredningskræfter), jo mere kræves det for at bryde dem og overgangen til gasfasen, hvilket resulterer i et højere kogepunkt.
* densitet er et mål for masse pr. Enhedsvolumen. Det er primært påvirket af pakningen af molekyler og deres molekylvægt.
* densitet og intermolekylære kræfter er ikke direkte forbundet. En tæt væske kan have svage intermolekylære kræfter (som kviksølv) og et lavt kogepunkt. Omvendt kan en mindre tæt væske have stærke intermolekylære kræfter (som vand) og et højt kogepunkt.
Eksempel:
* vand er mindre tæt end kviksølv , men det har et meget højere kogepunkt på grund af dets stærke brintbindinger.
der kan dog være et indirekte forhold:
* molekylvægt og densitet: Generelt er stoffer med højere molekylvægt tættere. Dette skyldes, at de har mere masse pakket i det samme volumen. Højere molekylvægt har også en tendens til at øge styrken af London -spredningskræfter, hvilket kan føre til et højere kogepunkt.
* Intermolekylære kræfter og densitet: Stærkere intermolekylære kræfter fører ofte til en højere densitet, fordi molekyler er mere tæt pakket.
Som konklusion, mens densiteten i sig selv ikke direkte påvirker kogepunktet, kan faktorer, der påvirker densitet (som molekylvægt og intermolekylære kræfter) indirekte påvirke kogepunktet.
 Varme artikler
Varme artikler
-
 Kemikere bringer blandede foldede proteiner til liveDen aluminiumoxid nanopartikel-assisteret enzym genfoldning proces er vist. Kredit:ITMO University Forskere fra ITMO University i Sankt Petersborg og Hebrew University i Jerusalem har fundet en må
Kemikere bringer blandede foldede proteiner til liveDen aluminiumoxid nanopartikel-assisteret enzym genfoldning proces er vist. Kredit:ITMO University Forskere fra ITMO University i Sankt Petersborg og Hebrew University i Jerusalem har fundet en må -
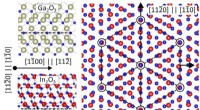 Ny katalytisk effekt fundet til fremstilling af galliumoxidMetaludvekslingskatalyse, som beskrevet, kan producere denne heterostruktur af galliumoxid-indiumoxid til ny elektronik baseret på galliumoxid. Kredit:PDI Halvledende oxider er en ny klasse af mat
Ny katalytisk effekt fundet til fremstilling af galliumoxidMetaludvekslingskatalyse, som beskrevet, kan producere denne heterostruktur af galliumoxid-indiumoxid til ny elektronik baseret på galliumoxid. Kredit:PDI Halvledende oxider er en ny klasse af mat -
 Bærbar elektronik til kontinuerlig hjerte, respirationsovervågningEn lille og billig sensor, annonceret i Applied Physics Letters og baseret på et elektrokemisk system, kan potentielt bæres uafbrudt af hjertepatienter eller andre, der kræver konstant overvågning. Hø
Bærbar elektronik til kontinuerlig hjerte, respirationsovervågningEn lille og billig sensor, annonceret i Applied Physics Letters og baseret på et elektrokemisk system, kan potentielt bæres uafbrudt af hjertepatienter eller andre, der kræver konstant overvågning. Hø -
 Defekter på overfladen af katalysatorer bestemmer deres aktivitetModel af et atomart trin på en katalysatoroverflade. På sådanne steder på en koboltkatalysator, den industrielle Fischer-Tropsch-syntese af dieselbrændstof finder sted. Kredit:J. Winterlin/LMU Man
Defekter på overfladen af katalysatorer bestemmer deres aktivitetModel af et atomart trin på en katalysatoroverflade. På sådanne steder på en koboltkatalysator, den industrielle Fischer-Tropsch-syntese af dieselbrændstof finder sted. Kredit:J. Winterlin/LMU Man
- Personaletilfredshed påvirker virksomhedens præstationer
- Hvordan den globale opvarmning udtørrer den nordamerikanske monsun
- Hvordan man sammenligner og identificerer frø og humane blodceller
- Hvordan opdages gasser i gæringsreaktioner?
- Det er ikke kun Brasiliens Amazonas regnskov, der brænder - bolivianske brande truer mennesker og d…
- US FCC blokerer for Huawei, ZTE fra tilskudsprogram


