Hvilke partikler fungerer sammen for at få atomer opfører sig som et faststof?
* atomer: Byggestenene i alle stoffer. De består af protoner, neutroner og elektroner.
* Elektroner: Disse partikler er ansvarlige for kemiske bindinger der holder atomer sammen i et fast stof. Der er to hovedtyper af obligationer:
* ioniske bindinger: Forekomme, når et atom donerer et elektron til en anden, der danner ladede ioner, der tiltrækker hinanden stærkt.
* kovalente obligationer: Forekommer, når to atomer deler elektroner, hvilket resulterer i en stærk attraktion mellem dem.
* Intermolekylære kræfter: Selv når atomer holdes sammen af stærke bindinger, er der svagere kræfter, der tiltrækker molekyler til hinanden. Disse kræfter er afgørende for at bestemme egenskaberne ved faste stoffer:
* van der Waals Forces: Disse svage attraktioner opstår på grund af midlertidige udsving i elektronfordeling omkring molekyler.
* Hydrogenbindinger: Disse er stærkere end van der Waals kræfter og forekommer, når brintatomer er bundet til stærkt elektronegative atomer som ilt eller nitrogen.
Hvordan disse interaktioner skaber solide egenskaber:
* Fast form og volumen: På grund af de stærke bindinger og intermolekylære kræfter holdes atomer i en fast, stiv struktur. Dette giver faste stoffer deres karakteristiske form og volumen.
* Høj densitet: Den tætte pakning af atomer i faste stoffer resulterer i høj densitet sammenlignet med væsker eller gasser.
* modstand mod komprimering: Stærke bindinger og kræfter gør faste stoffer vanskelige at komprimere.
* stivhed og elasticitet: Faststoffer kan modstå deformation under stress på grund af de stærke bindinger, der holder dem sammen.
Kortfattet: Det er kombinationen af stærke kemiske bindinger, der holder atomer sammen og svagere intermolekylære kræfter, der holder molekyler sammen, der definerer opførslen af et fast stof.
Sidste artikelEr helium og varm luft den samme gas?
Næste artikelHvad er materialerne produceret i en kemisk reaktion kaldet?
 Varme artikler
Varme artikler
-
 Alternativ proces til omdannelse af hvidt fosfor lover mere bæredygtighed i den kemiske industriDet er lykkedes TUD-kemikere specifikt at omdanne hvidt fosfor (P4) til et alternativt og meget mindre problematisk P-mellemreagens. Kredit:K. Schwedtmann, T. Schneider Kemikere ved Technische Univ
Alternativ proces til omdannelse af hvidt fosfor lover mere bæredygtighed i den kemiske industriDet er lykkedes TUD-kemikere specifikt at omdanne hvidt fosfor (P4) til et alternativt og meget mindre problematisk P-mellemreagens. Kredit:K. Schwedtmann, T. Schneider Kemikere ved Technische Univ -
 Nye værktøjer til at skabe spejlede former for molekylerGregory Fu og Zhaobin Wang hos Caltech. Kredit:Caltech En af de største udfordringer, som syntetiske kemikere står over for, er, hvordan man laver molekyler af kun en bestemt håndhævelse. Molekyle
Nye værktøjer til at skabe spejlede former for molekylerGregory Fu og Zhaobin Wang hos Caltech. Kredit:Caltech En af de største udfordringer, som syntetiske kemikere står over for, er, hvordan man laver molekyler af kun en bestemt håndhævelse. Molekyle -
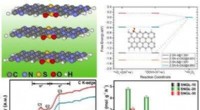 Forskere indser effektiv hydrogenperoxidproduktion i syreIllustration af forskningen. Kredit:Prof. Guans gruppe Som et af de 100 vigtigste kemikalier i verden er hydrogenperoxid (H2 O2 ) fremstilles hovedsageligt ved den energi- og affaldsintensive anthr
Forskere indser effektiv hydrogenperoxidproduktion i syreIllustration af forskningen. Kredit:Prof. Guans gruppe Som et af de 100 vigtigste kemikalier i verden er hydrogenperoxid (H2 O2 ) fremstilles hovedsageligt ved den energi- og affaldsintensive anthr -
 Cathinone farvetest er nu på markedetEn farvetest udviklet ved University of Technology Sydney kan nøjagtigt detektere tilstedeværelsen af alle kathinoner og er blevet kommercialiseret af det tysk-baserede firma ESA-Test. Den sælges nu
Cathinone farvetest er nu på markedetEn farvetest udviklet ved University of Technology Sydney kan nøjagtigt detektere tilstedeværelsen af alle kathinoner og er blevet kommercialiseret af det tysk-baserede firma ESA-Test. Den sælges nu
- Hvad er et eksempel på støkiometri?
- Nanostruktureret flad linse bruger maskinlæring til at se mere klart, mens der bruges mindre strøm…
- Beskriv de to metoder, som euglenophytes kan bruge til at opnå energi?
- To fordele ved en elektromagnet over en permanent magnet
- Kaldes en planet lavet af gas planet?
- Genvinde gaderne? Vi kan alle have indflydelse på den nye normal efter coronavirus


