Hvilken generel elektronarrangement er ledende for kemisk inaktivitet?
Her er hvorfor:
* atomer stræber efter stabilitet: Atomer er mest stabile, når deres yderste elektronskal (Valence Shell) er fuld. Dette skyldes, at en fuld valensskal indikerer, at alle de tilgængelige bindingsorbitaler er fyldt, hvilket gør atomet mindre sandsynligt at få, miste eller dele elektroner.
* inerte gasser: Elementerne i gruppe 18 i den periodiske tabel (ædelgasser) har fulde valensskaller. De er ekstremt ureaktive og danner sjældent kemiske bindinger. Eksempler inkluderer helium (HE), neon (NE), argon (AR) osv.
* octet regel: Mange atomer har en tendens til at vinde, miste eller dele elektroner for at opnå en stabil konfiguration med otte elektroner i deres yderste skal. Dette er kendt som Octet -reglen.
Undtagelser:
* brint og helium: Hydrogen har kun brug for to elektroner for at fylde sin valensskal, mens helium allerede har to elektroner. Dette er grunden til, at begge er meget stabile og ureaktive.
* tungere elementer: Nogle tungere elementer har mere komplicerede elektronkonfigurationer og kan udvise en vis grad af reaktivitet, selv med en fuld ydre skal.
Kortfattet: En fuld valensskal, især med otte elektroner, giver betydelig stabilitet og gør et element mindre tilbøjeligt til at deltage i kemiske reaktioner. Dette er grunden til, at ædle gasser er så ureaktive.
 Varme artikler
Varme artikler
-
 En teknologi til at omdanne 2-D-fly til 3D-bløde og fleksible strukturer ved at konstruere vedhæft…Elektrisk funktionalitet demonstreret på en fleksibel og blød 3D -enhed ved tilslutning af lysdioder. Kredit:DGIST Professor Sohee Kims forskerhold i Institut for Roboteknik har udviklet en teknol
En teknologi til at omdanne 2-D-fly til 3D-bløde og fleksible strukturer ved at konstruere vedhæft…Elektrisk funktionalitet demonstreret på en fleksibel og blød 3D -enhed ved tilslutning af lysdioder. Kredit:DGIST Professor Sohee Kims forskerhold i Institut for Roboteknik har udviklet en teknol -
 Sutters biosensor kan hjælpe med at overvåge nyfødtes sundhedEn sutebiosensor kan engang bruges til ikke-invasivt at overvåge glukose i spyt hos spædbørn. Kredit:Tilpasset fra Analytisk kemi 2019, DOI:10.1021/acs.analchem.9b03379 Bærbare biosensorer, der
Sutters biosensor kan hjælpe med at overvåge nyfødtes sundhedEn sutebiosensor kan engang bruges til ikke-invasivt at overvåge glukose i spyt hos spædbørn. Kredit:Tilpasset fra Analytisk kemi 2019, DOI:10.1021/acs.analchem.9b03379 Bærbare biosensorer, der -
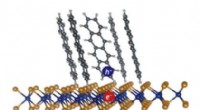 Hurtigt bevægende elektroner skaber strøm i organiske solcellerEn exciton (elektron-hul-par) dannet ved grænsefladen mellem tetracen-molekyler (en organisk halvleder) og enkeltlags WS2 (en uorganisk halvleder). Dissociation af sådanne grænseflade excitoner er nød
Hurtigt bevægende elektroner skaber strøm i organiske solcellerEn exciton (elektron-hul-par) dannet ved grænsefladen mellem tetracen-molekyler (en organisk halvleder) og enkeltlags WS2 (en uorganisk halvleder). Dissociation af sådanne grænseflade excitoner er nød -
 Opdagelsen afdækker behovet for ammoniakudledningsforskrifterDen Europæiske Organisation for Nuklear Forsknings (CERN) skykammer kan genskabe temperaturforhold overalt i atmosfæren, hvilket gør det muligt for forskere at overvåge og analysere partikeldannelse i
Opdagelsen afdækker behovet for ammoniakudledningsforskrifterDen Europæiske Organisation for Nuklear Forsknings (CERN) skykammer kan genskabe temperaturforhold overalt i atmosfæren, hvilket gør det muligt for forskere at overvåge og analysere partikeldannelse i


