Hvordan påvirker egenskaberne ved vandmolekyle overfladespænding?
1. Polaritet og hydrogenbinding:
* Polaritet: Vandmolekyler er polære, hvilket betyder, at de har en positiv ende (hydrogenatomer) og en negativ ende (iltatom). Denne polaritet giver dem mulighed for at danne stærke brintbindinger med hinanden.
* Hydrogenbinding: Disse hydrogenbindinger er stærke intermolekylære kræfter, langt stærkere end de typiske van der Waals-kræfter, der findes i ikke-polære molekyler. De fungerer som små "klæbrige" forbindelser mellem vandmolekyler.
2. Sammenhængende kræfter:
* stærk attraktion: Hydrogenbindingerne skaber stærke sammenhængende kræfter og tiltrækker vandmolekyler til hinanden. Disse kræfter er større inden for det flydende vand end på overfladen.
* overfladelag: På overfladen oplever vandmolekyler et netto indad træk fra de omgivende vandmolekyler. Dette skaber et "hud" eller overfladelag med højere densitet end bulkvæsken.
3. Minimering af overfladeareal:
* overfladespænding: Dette indadgående træk på grund af sammenhængende kræfter resulterer i overfladespænding, en kraft, der får vandoverfladen til at fungere som en elastisk membran.
* minimering af overfladeareal: Vandmolekylerne arrangerer naturligvis sig for at minimere overfladearealet, hvilket reducerer antallet af utilfredse brintbindinger. Dette er grunden til, at vanddråber er sfæriske, da kugler har det mindste overfladeareal for et givet volumen.
Kortfattet: Polariteten af vandmolekyler og de stærke brintbindinger, de danner, er ansvarlige for de høje sammenhængende kræfter og overfladespænding, der får vand til at opføre sig som en væske med et stærkt overfladelag. Denne overfladespænding er afgørende for mange biologiske processer og fænomener, såsom vandbevægelse gennem planter og insekternes evne til at gå på vand.
 Varme artikler
Varme artikler
-
 Oprettelse af mønstre spontant i syntetiske materialerEn polymerisationsfront markeret af varmegradienter (rød, højere temperatur) tillader spontan mønsterdannelse af polymerer med variable teksturer, farver og stivhed. Målestok, 1 cm. Kredit:Tilpasset f
Oprettelse af mønstre spontant i syntetiske materialerEn polymerisationsfront markeret af varmegradienter (rød, højere temperatur) tillader spontan mønsterdannelse af polymerer med variable teksturer, farver og stivhed. Målestok, 1 cm. Kredit:Tilpasset f -
 Brændstof og kemikalier fra planteaffaldPSI-forsker Patrick Hemberger ved VUV-strålelinjen af den schweiziske lyskilde SLS. Her undersøgte han og kolleger detaljerne omkring nedbrydningen af lignin til andre stoffer. Resultaterne kan bi
Brændstof og kemikalier fra planteaffaldPSI-forsker Patrick Hemberger ved VUV-strålelinjen af den schweiziske lyskilde SLS. Her undersøgte han og kolleger detaljerne omkring nedbrydningen af lignin til andre stoffer. Resultaterne kan bi -
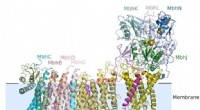 Mikrober fra marine vulkanske ventilationsåbninger afslører, hvordan mennesker tilpassede sig en æ…MBH strukturen. Kredit:Huilin Li, Ph.D., Michael W.W. Adams &Hongjun Yu, Ph.d. Gamle mikrober, der trives i nogle af verdens mest ekstreme miljøer og nutidens mennesker, har mere tilfælles end man
Mikrober fra marine vulkanske ventilationsåbninger afslører, hvordan mennesker tilpassede sig en æ…MBH strukturen. Kredit:Huilin Li, Ph.D., Michael W.W. Adams &Hongjun Yu, Ph.d. Gamle mikrober, der trives i nogle af verdens mest ekstreme miljøer og nutidens mennesker, har mere tilfælles end man -
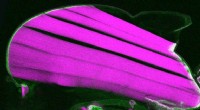 Hvordan holder muskel- og seneforbindelser hele livet?Skær i længderetningen gennem thoraxen på en frugtflue med en indsat kraftsensor i talinproteinet. Kraftsensoren på muskel-seneforbindelserne er grøn, og flyvemusklerne er magenta. Kredit:S. Lemke et
Hvordan holder muskel- og seneforbindelser hele livet?Skær i længderetningen gennem thoraxen på en frugtflue med en indsat kraftsensor i talinproteinet. Kraftsensoren på muskel-seneforbindelserne er grøn, og flyvemusklerne er magenta. Kredit:S. Lemke et
- Hvad er udånding og indånding?
- Hvilket problem ville folk have, hvis de ikke phenylalanin hydroxylase?
- Hvorfor vi har hager:Forskere hævder, at hage kommer fra evolution, ikke mekaniske kræfter
- Udvides alle gasser ved opvarmning?
- Tal begrænser, hvor præcist digitale computere modellerer kaos
- Udsigter i forsyningskæden:Hvorfor situationen varierer fra branche til branche


