Er et vandmolekyle beskrevet som værende polært eller ikke, og hvorfor?
* ujævn deling af elektroner: Oxygenatomet i vand er mere elektronegativ end hydrogenatomerne. Dette betyder, at det tiltrækker de delte elektroner i de kovalente bindinger stærkere. Dette resulterer i, at iltatomet har en lidt negativ ladning (Δ-) og hydrogenatomerne med lidt positive ladninger (Δ+).
* bøjet molekylær form: Vandmolekylet har en bøjet form, ligesom en V. Denne form sammen med den ujævne elektronfordeling skaber en adskillelse af ladning inden for molekylet. Oxygen -siden har en negativ pol, og brintsiden har en positiv pol.
Sammenfattende opstår polariteten af et vandmolekyle fra dens asymmetriske form og den ulige deling af elektroner mellem ilt- og brintatomer.
 Varme artikler
Varme artikler
-
 En ny måde at teste kropspanser påFørstehjælpere er blandt dem, hvis liv afhænger af rustning - og de ballistiske fibre inde i dem. Kredit:Shutterstock Forskere ved National Institute of Standards and Technology (NIST) har udvikle
En ny måde at teste kropspanser påFørstehjælpere er blandt dem, hvis liv afhænger af rustning - og de ballistiske fibre inde i dem. Kredit:Shutterstock Forskere ved National Institute of Standards and Technology (NIST) har udvikle -
 Ugiftig flammehæmmer kommer på markedetSkumprøve med EDA-DOPO i en flammetest i Empa laboratoriet. Kredit:Empa Kemikere fra Empa har udviklet og patenteret en miljøvenlig måde at fremstille flammehæmmere til skum, der kan bruges i madr
Ugiftig flammehæmmer kommer på markedetSkumprøve med EDA-DOPO i en flammetest i Empa laboratoriet. Kredit:Empa Kemikere fra Empa har udviklet og patenteret en miljøvenlig måde at fremstille flammehæmmere til skum, der kan bruges i madr -
 Nyopdaget kvasikrystal blev skabt ved den første atomeksplosion på Trinity SiteBillede af rød trinititprøve, der indeholdt kvasicrystal. Kredit:Luca Bindi og Paul J. Steinhardt. En nyopdaget kvasikrystal, der blev skabt ved den første atomeksplosion på Trinity Site, N.M., de
Nyopdaget kvasikrystal blev skabt ved den første atomeksplosion på Trinity SiteBillede af rød trinititprøve, der indeholdt kvasicrystal. Kredit:Luca Bindi og Paul J. Steinhardt. En nyopdaget kvasikrystal, der blev skabt ved den første atomeksplosion på Trinity Site, N.M., de -
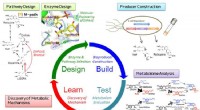 Konstruerede smarte celler forbedrer produktionen af farmaceutiske råvarerFigur 1 - Et design, Byg, Prøve, Lær workflow aktiveret forbedring af alkaloidproduktion. Kredit:Kobe University Forskere i Japan har udviklet et integreret syntetisk biologisk system til at konst
Konstruerede smarte celler forbedrer produktionen af farmaceutiske råvarerFigur 1 - Et design, Byg, Prøve, Lær workflow aktiveret forbedring af alkaloidproduktion. Kredit:Kobe University Forskere i Japan har udviklet et integreret syntetisk biologisk system til at konst
- Mars er stadig en aktiv verden - her er et jordskred i Nili Fossae
- Selvrensende optisk fiber kan hjælpe med at overvåge miljøet og diagnosticere kræft
- Huler indikerer, at Australiens bjerge stadig vokser
- Kinas klimatilstand i 2018:Flere ekstreme begivenheder, men mindre tab
- Hvad er det lag af jorden, som du står på, og et par miles tyk?
- Sådan fungerer lufthavnssikkerhed


