Hvorfor er vand mere tilbøjelige til at interagere med ioner end neutrale molekyler?
Her er hvorfor:
* Polaritet: Vandmolekyler har en bøjet form, hvor iltatomet er lidt negativt ladet, og brintatomerne er lidt positivt ladet. Denne polaritet skaber et dipolmoment, hvilket gør vand til et polært opløsningsmiddel.
* Hydrogenbinding: Vandmolekyler kan danne hydrogenbindinger med hinanden og med andre polære molekyler. De delvist positive hydrogenatomer i vand tiltrækkes af de delvist negative iltatomer i andre vandmolekyler eller i polære molekyler.
Interaktion med ioner:
* Elektrostatiske interaktioner: Ioner, der er ladede partikler, har stærke elektrostatiske interaktioner med de polære vandmolekyler. De modsatte ladninger tiltrækker hinanden og skaber en hydratiseringsskal omkring ion. Denne skal hjælper med at stabilisere ionen i opløsningen og forhindrer den i at komme igen med sin modsatte ladede modstykke.
interaktion med neutrale molekyler:
* svage interaktioner: Neutrale molekyler, der mangler en ladning, har svagere interaktioner med vandmolekyler. Disse interaktioner skyldes primært van der Waals -kræfter, som er meget svagere end elektrostatiske interaktioner.
Kortfattet:
Vandets polære natur og evne til at danne hydrogenbindinger giver det mulighed for effektivt at solvere ioner, hvilket skaber stærke elektrostatiske interaktioner. Neutrale molekyler, der mangler en ladning, har meget svagere interaktioner med vand på grund af svagere van der Waals -styrker. Dette er grunden til, at vand er mere tilbøjelige til at interagere med ioner end neutrale molekyler.
Sidste artikelEr et atom mindre end et molekyle?
Næste artikelEr kulhydrater det samme som kulbrinter?
 Varme artikler
Varme artikler
-
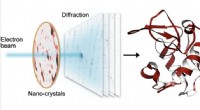 Sniger op på små krystaller med elektrondiffraktionVed seriel elektrondiffraktion, en lille elektronstråle rammer sekventielt tusindvis af små krystaller lavet af proteiner, som spreder strålen i diffraktionsmønstre. Fra disse mønstre, strukturen af
Sniger op på små krystaller med elektrondiffraktionVed seriel elektrondiffraktion, en lille elektronstråle rammer sekventielt tusindvis af små krystaller lavet af proteiner, som spreder strålen i diffraktionsmønstre. Fra disse mønstre, strukturen af -
 Hvordan computere søger efter fremtidens stofferKredit:University of California, San Francisco Opdagelse af lægemidler kan bringe tankerne hen på billeder af hvide laboratoriefrakker og pipetter, men da Henry Lin, PhD, for nylig satte sig for a
Hvordan computere søger efter fremtidens stofferKredit:University of California, San Francisco Opdagelse af lægemidler kan bringe tankerne hen på billeder af hvide laboratoriefrakker og pipetter, men da Henry Lin, PhD, for nylig satte sig for a -
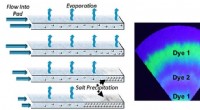 Papirbaseret enhed giver lavt strømforbrug, langsigtet metode til at analysere svedFordampningen af sved på papirpuder kunne bruges til væsketransport i wearables over lange perioder. Det resulterende tørre lag af kagede salte ville bevare en tidsstemplet registrering af biomarkør
Papirbaseret enhed giver lavt strømforbrug, langsigtet metode til at analysere svedFordampningen af sved på papirpuder kunne bruges til væsketransport i wearables over lange perioder. Det resulterende tørre lag af kagede salte ville bevare en tidsstemplet registrering af biomarkør -
 Belyse spørgsmålet om vinsvindelKredit:University of Adelaide University of Adelaide vinforskere er ved at udvikle en hurtig og enkel metode til at autentificere vin - en potentiel løsning mod den anslåede vinsvindel for milliar
Belyse spørgsmålet om vinsvindelKredit:University of Adelaide University of Adelaide vinforskere er ved at udvikle en hurtig og enkel metode til at autentificere vin - en potentiel løsning mod den anslåede vinsvindel for milliar


