Hvordan er isotoper af et givet element forskellige, er de ens?
* Samme atomnummer (antal protoner): Dette definerer elementet. Så alle isotoper af kulstof vil have 6 protoner.
* samme kemiske egenskaber: Isotoper opfører sig generelt på samme måde i kemiske reaktioner på grund af at have det samme antal elektroner.
* samme antal elektroner: Da de har det samme antal protoner, har de også det samme antal elektroner til at afbalancere ladningen.
Imidlertid er isotoper forskellige På disse måder:
* Forskellige massetal (antal protoner + antal neutroner): Dette er den mest betydningsfulde forskel. Isotoper har det samme antal protoner, men forskellige antal neutroner. For eksempel har carbon-12 6 protoner og 6 neutroner, mens carbon-14 har 6 protoner og 8 neutroner.
* forskellige fysiske egenskaber: Dette kan omfatte ting som smeltepunkt, kogepunkt og densitet. Disse forskelle skyldes den varierende masse af isotoperne.
* forskellige radioaktive egenskaber: Nogle isotoper er radioaktive, hvilket betyder, at de forfalder over tid, mens andre er stabile. De radioaktive isotoper bruges ofte i medicinsk billeddannelse og dateringsteknikker.
Kortfattet:
Isotoper af et element er som forskellige versioner af det samme element med det samme antal protoner og elektroner, men adskiller sig i deres antal neutroner. Denne forskel i neutronantal fører til variationer i masse og undertiden radioaktivitet.
Sidste artikelHvilke to subatomiske partikler findes i kernen?
Næste artikelHvad er en keloid lavet af?
 Varme artikler
Varme artikler
-
 Manganoxidmateriale kan hurtigt lagre og frigive lavgradig varme uden at nedbrydesVarme frigives fra manganoxidmaterialet, når vandmolekyler trænger ind i dets lagdelte struktur. Kredit:Norihiko L. Okamoto Forskere i Japan har fundet et almindeligt stof, der reversibelt og hurti
Manganoxidmateriale kan hurtigt lagre og frigive lavgradig varme uden at nedbrydesVarme frigives fra manganoxidmaterialet, når vandmolekyler trænger ind i dets lagdelte struktur. Kredit:Norihiko L. Okamoto Forskere i Japan har fundet et almindeligt stof, der reversibelt og hurti -
 Gør plastik mere gennemsigtigt og tilføjer samtidig elektrisk ledningsevneJay Guo har et ark med fleksibel gennemsigtig dirigent på University of Michigans College of Engineering North Campus. Materialet lægger et tyndt lag sølv mellem to dielektriske materialer, aluminiumo
Gør plastik mere gennemsigtigt og tilføjer samtidig elektrisk ledningsevneJay Guo har et ark med fleksibel gennemsigtig dirigent på University of Michigans College of Engineering North Campus. Materialet lægger et tyndt lag sølv mellem to dielektriske materialer, aluminiumo -
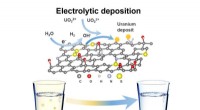 Brug af grafenskum til at filtrere toksiner fra drikkevandEt genanvendeligt 3D-funktionaliseret reduceret grafenoxidskum (3D-FrGOF) bruges som en in situ elektrolytisk aflejringselektrode til at udvinde uran fra forurenet vand. Kredit:MIT Nogle former fo
Brug af grafenskum til at filtrere toksiner fra drikkevandEt genanvendeligt 3D-funktionaliseret reduceret grafenoxidskum (3D-FrGOF) bruges som en in situ elektrolytisk aflejringselektrode til at udvinde uran fra forurenet vand. Kredit:MIT Nogle former fo -
 Elektronisk chip efterligner hjernen for at skabe minder på et øjeblikNy chip er baseret på et ultratyndt materiale, der ændrer elektrisk modstand som reaktion på forskellige bølgelængder af lys. Kredit:RMIT University Forskere fra RMIT University har hentet inspira
Elektronisk chip efterligner hjernen for at skabe minder på et øjeblikNy chip er baseret på et ultratyndt materiale, der ændrer elektrisk modstand som reaktion på forskellige bølgelængder af lys. Kredit:RMIT University Forskere fra RMIT University har hentet inspira
- Hvad er den mindste enhed i en levende organisme eller ikke -levende ting?
- Hvorfor repræsenterer i øjeblikket vedvarende ressourcer en meget lille procentdel af det samlede …
- Hvilket objekt lagrer gravitationspotentiale energi?
- En laser, der sporer som en jagthund
- Hvordan tester man iltindholdet i dåseprodukt?
- Hvad er de kemiske sanser?


