Tiltrækningen mellem vandmolekyler er resultatet af vand?
Her er hvorfor:
* Polaritet: Vandmolekyler er polære, hvilket betyder, at de har en lidt positiv ende (nær brintatomerne) og en lidt negativ ende (nær iltatomet).
* Hydrogenbindinger: Det lidt positive brint ende af et vandmolekyle tiltrækkes af den lidt negative ilt ende af et andet vandmolekyle. Denne attraktion kaldes en brintbinding.
Hydrogenbindinger er relativt svage sammenlignet med kovalente bindinger, men de er stærke nok til at holde vandmolekyler sammen, hvilket giver vand mange af dets unikke egenskaber:
* Højt kogepunkt: Vand har et højere kogepunkt end mange andre væsker, fordi brintbindinger skal brydes for at skifte vand fra en væske til en gas.
* Høj overfladespænding: Hydrogenbindinger skaber en stærk sammenhængende kraft mellem vandmolekyler, hvilket giver vand en høj overfladespænding.
* Fremragende opløsningsmiddel: Polariteten af vandmolekyler giver dem mulighed for at opløse mange stoffer.
Så tiltrækningen mellem vandmolekyler er et resultat af molekylernes polære karakter og dannelsen af brintbindinger .
 Varme artikler
Varme artikler
-
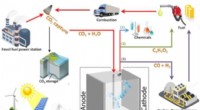 Forskere laver alkohol ud af den blå luftTre forskellige måder, hvorpå elektroreduktion af CO2 potentielt kan lukke kulstofkredsløbet. Kredit:Delft University of Technology Det lyder måske for godt til at være sandt, men TU Delft-ph.d.-s
Forskere laver alkohol ud af den blå luftTre forskellige måder, hvorpå elektroreduktion af CO2 potentielt kan lukke kulstofkredsløbet. Kredit:Delft University of Technology Det lyder måske for godt til at være sandt, men TU Delft-ph.d.-s -
 Miniproteiner, der kan lancere tostrengede angreb på virale proteinerDimerisering af spidsprotein med to-sidet peptid. Kredit:Bhavesh Khatri Den hurtige fremkomst af nye stammer af SARS-CoV-2-viruset har formindsket beskyttelsen fra COVID-19-vacciner. En ny tilgang
Miniproteiner, der kan lancere tostrengede angreb på virale proteinerDimerisering af spidsprotein med to-sidet peptid. Kredit:Bhavesh Khatri Den hurtige fremkomst af nye stammer af SARS-CoV-2-viruset har formindsket beskyttelsen fra COVID-19-vacciner. En ny tilgang -
 Et revolutionerende materiale til rumfart og neuromorfisk databehandlingVanadium Dioxide chip udviklet på EPFLs NANOLAB. Kredit:EPFL / Jamani Caillet Først kom omskifteren. Derefter transistoren. Nu står en anden innovation for at revolutionere den måde, vi styrer ele
Et revolutionerende materiale til rumfart og neuromorfisk databehandlingVanadium Dioxide chip udviklet på EPFLs NANOLAB. Kredit:EPFL / Jamani Caillet Først kom omskifteren. Derefter transistoren. Nu står en anden innovation for at revolutionere den måde, vi styrer ele -
 Strontiumtitanats nye egenskaber er vigtige for elektronikforskningEPR-spektre for de (001)-orienterede enkeltkrystalprøver med form som en stang og en plade af STO:Fe3+ ved T =300 K (a) og af en plade af STO:Mn4+ ved T =150 K (b) . Orienteringerne af prøverne i forh
Strontiumtitanats nye egenskaber er vigtige for elektronikforskningEPR-spektre for de (001)-orienterede enkeltkrystalprøver med form som en stang og en plade af STO:Fe3+ ved T =300 K (a) og af en plade af STO:Mn4+ ved T =150 K (b) . Orienteringerne af prøverne i forh
- Forureningskontrol af floder kan reducere virkningen af klimaopvarmning
- Hvor blev disse elektroner af? Årtiers gammelt mysterium løst
- Er solen et eksempel på termisk energi?
- Hvordan producerer du bevægelsen af et objekt?
- Hvad er perioden med revolution omkring centergalaksen?
- Undersøgelse viser, hvordan ru mikropartikler kan give store problemer


