Den faldende rækkefølge for de relative styrker af kemiske bindinger?
stærkest til svageste:
1. kovalente obligationer: Disse involverer deling af elektroner mellem atomer. De er den stærkeste type binding og er ansvarlige for at holde de fleste molekyler sammen.
* Eksempler: Bindingerne i vand (H₂O), metan (CH₄) og diamant (C).
* faktorer, der påvirker styrke:
* obligationsordre: Flere obligationer (dobbelt- og tredobbelt obligationer) er stærkere end enkeltobligationer.
* Elektronegativitet: Bindinger mellem atomer med lignende elektronegativiteter (tendens til at tiltrække elektroner) er stærkere.
* Størrelse på atomer: Mindre atomer danner stærkere kovalente bindinger.
2. ioniske bindinger: Disse involverer den elektrostatiske tiltrækning mellem modsat ladede ioner (atomer, der har vundet eller mistet elektroner).
* Eksempler: Natriumchlorid (NaCl), kaliumbromid (KBR) og magnesiumoxid (MGO).
* faktorer, der påvirker styrke:
* Gebyr for ioner: Højere ladninger fører til stærkere ioniske bindinger.
* Afstand mellem ioner: Mindre ioner og nærmere nærhed resulterer i stærkere bindinger.
3. Metalliske obligationer: Disse forekommer i metaller og involverer deling af delokaliserede elektroner blandt et gitter af positivt ladede metalioner. De er ansvarlige for metallers karakteristiske egenskaber, som god ledningsevne.
* Eksempler: Kobber (Cu), guld (AU), jern (Fe).
* faktorer, der påvirker styrke:
* Antal valenselektroner: Flere valenselektroner, der er tilgængelige til delokalisering, fører til stærkere bindinger.
* Størrelse på atomer: Mindre atomer med en højere tæthed af valenselektroner fører til stærkere metalliske bindinger.
4. Hydrogenbindinger: Dette er specielle dipol-dipolinteraktioner, der involverer et hydrogenatom bundet til et stærkt elektronegativt atom (som ilt, nitrogen eller fluor). De er relativt svage, men vigtige i mange biologiske systemer.
* Eksempler: Vand (H₂O) molekyler, DNA -struktur.
* faktorer, der påvirker styrke:
* Elektronegativitet: Højere elektronegativitet af atomet bundet til brint resulterer i stærkere brintbindinger.
5. van der Waals Forces: Dette er de svageste intermolekylære kræfter. De stammer fra midlertidige udsving i elektronfordeling, hvilket fører til kortvarige dipoler.
* Typer: London Dispersion Forces, Dipole-Dipole-interaktioner.
* Eksempler: Midlertidige attraktioner mellem ædle gasatomer, interaktioner mellem ikke -polære molekyler.
Nøglepunkter:
* Denne ordre er en generalisering. Styrken af en bestemt binding afhænger af de involverede specifikke atomer og betingelserne omkring dem.
* De relative styrker af forskellige typer kemiske bindinger kan have en betydelig indflydelse på stoffernes fysiske og kemiske egenskaber.
Fortæl mig, hvis du gerne vil have flere detaljer om en bestemt type obligation!
Sidste artikelHvilken kraft holder forbindelser sammen?
Næste artikelHvorfor er molekyler ikke en del af niveauet organisation?
 Varme artikler
Varme artikler
-
 Ny teknologi vil gøre det muligt at fremstille vigtige metaller mere effektivtVed at tilføje kombinationer af kulstof, brint, og iltatomer til stædige, svære at fordampe metaller som wolfram og platin, University of Minnesota Twin Cities forskere var i stand til at omdanne elem
Ny teknologi vil gøre det muligt at fremstille vigtige metaller mere effektivtVed at tilføje kombinationer af kulstof, brint, og iltatomer til stædige, svære at fordampe metaller som wolfram og platin, University of Minnesota Twin Cities forskere var i stand til at omdanne elem -
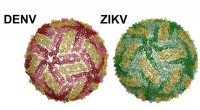 Forskere opdager, hvordan kropstemperatur ødelægger potentiel dengue, Zika-vaccineEn dengue-viruspartikel til venstre. Zika til højre. Kredit:UNC School of Medicine En vigtig vej mod at skabe effektive vacciner mod dengue-virus og Zika involverer E-proteinet, der dækker overfla
Forskere opdager, hvordan kropstemperatur ødelægger potentiel dengue, Zika-vaccineEn dengue-viruspartikel til venstre. Zika til højre. Kredit:UNC School of Medicine En vigtig vej mod at skabe effektive vacciner mod dengue-virus og Zika involverer E-proteinet, der dækker overfla -
 Forskere skaber stærke, hurtig, vandtæt klæbemiddelEn katalysator (for at få klæbemidlet til at holde hurtigt) og en tværbinder (for at gøre hold stærk) er anbragt i en lille mikrokapsel, der ligner en æggeskal, der går i stykker og frigiver tilsætnin
Forskere skaber stærke, hurtig, vandtæt klæbemiddelEn katalysator (for at få klæbemidlet til at holde hurtigt) og en tværbinder (for at gøre hold stærk) er anbragt i en lille mikrokapsel, der ligner en æggeskal, der går i stykker og frigiver tilsætnin -
 Hvordan de første biomolekyler kunne være blevet dannetKredit:Unsplash/CC0 Public Domain De kemiske forstadier til nutidens biomolekyler kunne være dannet ikke kun i dybhavet ved hydrotermiske åbninger, men også i varme damme på jordens overflade. De k
Hvordan de første biomolekyler kunne være blevet dannetKredit:Unsplash/CC0 Public Domain De kemiske forstadier til nutidens biomolekyler kunne være dannet ikke kun i dybhavet ved hydrotermiske åbninger, men også i varme damme på jordens overflade. De k
- Hvad er molekyler, som både polære og ikke-polære kaldes?
- Hvor bruges vindenergi i dag?
- Hvilken planet har den mindste bane og den største bane?
- Hvad er et kæmpe udbrud på Suns -overfladen?
- Forskere er i stand til at udlede formen baseret på dens?
- Coronavirus:Udledningen af nitrogendioxid falder over Italien


