Hvilken kraft holder forbindelser sammen?
1. Ioniske bindinger: Disse bindinger dannes, når et atom mister et elektron til et andet atom. De resulterende modsat ladede ioner tiltrækker hinanden elektrostatisk. Dette skaber en stærk, ikke-retningsbestemt binding, der ofte findes i salte som NaCl.
2. Kovalente obligationer: Disse bindinger dannes, når atomer deler elektroner. De delte elektroner tiltrækkes af kernerne i begge atomer, hvilket skaber en stærk binding. Kovalente bindinger kan være polære eller ikke -polære afhængigt af elektronegativitetsforskellen mellem atomerne. Denne type binding findes i mange organiske forbindelser og molekyler som vand.
3. Metalliske bindinger: Denne type binding forekommer i metaller, hvor elektroner delokaliseres og bevæger sig frit gennem metalgitteret. Dette skaber en stærk binding, der tegner sig for metaller med høj ledningsevne, formbarhed og duktilitet.
4. Intermolekylære kræfter: Selvom de ikke er teknisk kemiske bindinger, er disse kræfter svagere attraktioner mellem molekyler. De inkluderer:
* Hydrogenbindinger: En speciel type dipol-dipolinteraktion, der involverer hydrogen bundet til et stærkt elektronegativt atom som ilt eller nitrogen.
* dipol-dipolinteraktioner: Attraktioner mellem polære molekyler på grund af deres permanente dipoler.
* London Dispersion Forces: Svage midlertidige attraktioner, der stammer fra midlertidige udsving i elektronfordeling i molekyler.
Sammenfattende er kemiske bindinger den primære kraft, der holder forbindelser sammen, mens intermolekylære kræfter påvirker samspillet mellem molekyler.
 Varme artikler
Varme artikler
-
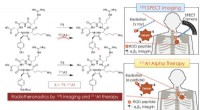 Radioisotoppar til tumordiagnose og terapiKonceptet radiotheranostics ved hjælp af At-211 og I-123 til kræftdiagnose og terapi. Kombination af SPECT-billeddannelse ved hjælp af I-123-mærket RGD-peptid med målrettet alfa-terapi ved hjælp af At
Radioisotoppar til tumordiagnose og terapiKonceptet radiotheranostics ved hjælp af At-211 og I-123 til kræftdiagnose og terapi. Kombination af SPECT-billeddannelse ved hjælp af I-123-mærket RGD-peptid med målrettet alfa-terapi ved hjælp af At -
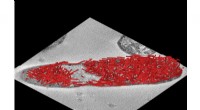 Bakterieudvikling markerer en ny æra inden for cellulært designGrafisk billede af rørformede stilladser i celler. Kredit:University of Kent Forskere ved universiteterne i Kent og Bristol har bygget et miniaturestillads inde i bakterier, der kan bruges til at
Bakterieudvikling markerer en ny æra inden for cellulært designGrafisk billede af rørformede stilladser i celler. Kredit:University of Kent Forskere ved universiteterne i Kent og Bristol har bygget et miniaturestillads inde i bakterier, der kan bruges til at -
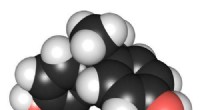 Nye katalysatorer fjerner effektivt og hurtigt BPA fra vand3D -kemisk struktur af bisphenol A. Kredit:Edgar181 via Wikimedia Commons Carnegie Mellon University -kemiker Terrence J. Collins har udviklet en tilgang, der hurtigt og billigt fjerner mere end 9
Nye katalysatorer fjerner effektivt og hurtigt BPA fra vand3D -kemisk struktur af bisphenol A. Kredit:Edgar181 via Wikimedia Commons Carnegie Mellon University -kemiker Terrence J. Collins har udviklet en tilgang, der hurtigt og billigt fjerner mere end 9 -
 3-D katalysatorer til forbedrede hydrazinfrie drivmidlerKredit:RHEFORM Hydrazin, et af de mest udbredte flydende drivmidler til rumfremdrivningssystemer, er også ekstremt giftig. EU-forskere har udviklet 3D-katalysatorer til antændelse af alternative d
3-D katalysatorer til forbedrede hydrazinfrie drivmidlerKredit:RHEFORM Hydrazin, et af de mest udbredte flydende drivmidler til rumfremdrivningssystemer, er også ekstremt giftig. EU-forskere har udviklet 3D-katalysatorer til antændelse af alternative d
- Hvad er målet for energibevægelse og partikler?
- Videnskaben siger:Vejrudsigterne forbedres, under radaren
- Underliggende mikrobielle mekanismer, der driver temperaturfølsomheden af jordrespiration, varier…
- Er energi og betyder det samme?
- Astronauter kan en dag drikke vand fra gamle månevulkaner
- Biokompatible kvanteprikker billeder af tumorer i levende dyr


