Hvorfor opløses salt i vand?
1. Saltens struktur:
* Tabel salt (natriumchlorid, NaCI) er en ionisk forbindelse. Det består af positivt ladede natriumioner (Na+) og negativt ladede chloridioner (Cl-) holdt sammen af elektrostatiske kræfter.
2. Strukturen af vand:
* Vand (H2O) er et polært molekyle. Oxygenatomet har en lidt negativ ladning, og brintatomerne har lidt positive ladninger.
3. Opløsningen "dans":
* attraktion: Når salt tilsættes til vand, omgiver de polære vandmolekyler saltet. De positive ender af vandmolekylerne (hydrogenatomer) tiltrækkes af de negativt ladede chloridioner (Cl-), mens de negative ender af vandmolekylerne (iltatomer) tiltrækkes af de positivt ladede natriumioner (Na+).
* adskillelse: Disse attraktioner er stærke nok til at overvinde de elektrostatiske kræfter, der holder natrium- og chloridioner sammen i saltkrystallen. Dette får saltkrystallen til at gå i stykker, og ionerne bliver omgivet af vandmolekyler.
* solvation: Ionerne er nu omgivet af en skal af vandmolekyler, en proces kaldet solvation. Ionerne er effektivt "opløst" i vandet.
I det væsentlige: Vandets polaritet giver det mulighed for at bryde de ioniske bindinger i salt, hvilket resulterer i opløste ioner.
Yderligere punkter:
* Processen med at opløse salt i vand er eksoterm, hvilket betyder, at den frigiver varme.
* Opløseligheden af salt i vand øges med temperaturen. Dette betyder, at du kan opløse mere salt i varmt vand end i koldt vand.
* Ikke alle stoffer opløses i vand. Ikke-polære stoffer, som olie, tiltrækkes ikke af vandmolekyler og opløses ikke.
 Varme artikler
Varme artikler
-
 Forskere opdager en ny mekanisme, der regulerer plan cellepolaritetTransportkøretøjer med Frizzled-6. Kredit:HKUST Plan celle polaritet (PCP), en proces, hvor epitelvævet polariseres inden i epitelets plan, spiller en vigtig rolle i udvikling og organfunktion. De
Forskere opdager en ny mekanisme, der regulerer plan cellepolaritetTransportkøretøjer med Frizzled-6. Kredit:HKUST Plan celle polaritet (PCP), en proces, hvor epitelvævet polariseres inden i epitelets plan, spiller en vigtig rolle i udvikling og organfunktion. De -
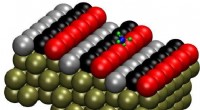 Lokalisering af den præcise reaktionsvej:Metan-dissociation på platinPt(211)-overfladen har tre-atom-brede terrasser og et-atom-høje trin. Forskerne mærkede rækken af atomer på trinkanten som trin (rød), den midterste række som terrasse (sort) og den sidste række som
Lokalisering af den præcise reaktionsvej:Metan-dissociation på platinPt(211)-overfladen har tre-atom-brede terrasser og et-atom-høje trin. Forskerne mærkede rækken af atomer på trinkanten som trin (rød), den midterste række som terrasse (sort) og den sidste række som -
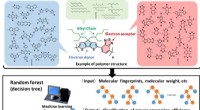 AI-software hjælper med design af nyt materiale til solcellerFig. 1. Udforskning af nye polymerer til polymersolceller ved hjælp af materialeinformatik. (Øvre) Eksempel på en polymerstruktur bestående af elektrondonor, elektronacceptor, og alkylkæder. (Mellem)
AI-software hjælper med design af nyt materiale til solcellerFig. 1. Udforskning af nye polymerer til polymersolceller ved hjælp af materialeinformatik. (Øvre) Eksempel på en polymerstruktur bestående af elektrondonor, elektronacceptor, og alkylkæder. (Mellem) -
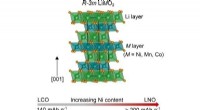 Køreplanen skitserer forhindringer i næste generations katodeudvikling til at drive elektriske kø…Krystalstruktur til lagdelte overgangsmetaloxidkatodematerialer, viser arrangementet af lithium og overgangsmetalkationer på tværs af separate lag. Kredit:Beth Johnston Overgangen til elektriske k
Køreplanen skitserer forhindringer i næste generations katodeudvikling til at drive elektriske kø…Krystalstruktur til lagdelte overgangsmetaloxidkatodematerialer, viser arrangementet af lithium og overgangsmetalkationer på tværs af separate lag. Kredit:Beth Johnston Overgangen til elektriske k
- Forskere udvikler en lastbil til at producere biogødning
- Nordkorea udforsker sanktionssikre energiteknologier
- Gav det at spise stivelsesholdige fødevarer mennesker en evolutionær fordel?
- Hvordan videnskaben graver det kongelige snavs op
- Hvilke to mineraler fungerer som cement i sedimentære klipper?
- Hvad er de tre typer friktionsfysik?


