Hvad er eksempler på syrer under pH 0?
* PH -skalaen er logaritmisk: Dette betyder, at hvert hele antal fald i pH repræsenterer en ti gange stigning i surhedsgrad.
* stærke syrer adskiller sig fuldstændigt: Stærke syrer som saltsyre (HCI) og svovlsyre (H2SO4) frigiver næsten alle deres hydrogenioner (H+) i opløsning. Selv stærke syrer har imidlertid grænser.
* Praktiske begrænsninger: Måling af pH under 0 bliver meget teknisk udfordrende. Standard pH -prober og målemetoder er designet til en rækkevidde fra 0 til 14.
Så mens teoretisk syrer med pH under 0 kunne eksistere, her er hvorfor de er ekstremt sjældne:
* koncentrerede stærke syrer: Ekstremt høje koncentrationer af stærke syrer som koncentreret svovlsyre (H2SO4) eller koncentreret saltsyre (HCI) kan nærme sig pH -værdier tæt på 0. men disse opløsninger er ekstremt farlige og ætsende.
* Superacids: Superacides er en speciel klasse af ekstremt sure forbindelser, der er endnu stærkere end typiske stærke syrer. De kan have negative pH -værdier. Eksempler inkluderer:
* fluorulfursyre (HSO3F): Denne syre er utrolig stærk og kan opløse glas.
* magisk syre (FSO3H-SBF5): Denne blanding er endnu mere potent end fluorulfurinsyre.
Vigtig note: Arbejde med superacider og stærkt koncentrerede stærke syrer kræver specialiseret udstyr og ekstrem forsigtighed på grund af deres ekstreme reaktivitet og ætsende karakter.
Fortæl mig, hvis du har andre spørgsmål!
 Varme artikler
Varme artikler
-
 Spinifex lover stærkere kondomerKredit:CC0 Public Domain Spinifex græs kunne bruges til at skabe tyndere, stærkere latex til handsker og kondomer, samt mere holdbare tætninger og dæk, siger en australsk videnskabsmand. Advance
Spinifex lover stærkere kondomerKredit:CC0 Public Domain Spinifex græs kunne bruges til at skabe tyndere, stærkere latex til handsker og kondomer, samt mere holdbare tætninger og dæk, siger en australsk videnskabsmand. Advance -
 Automatisk syntese giver mulighed for opdagelse af uventet ladningstransportadfærd i organiske mole…Automatiseret synteseplatform i Molecule Marker Lab. Kredit:University of Illinois Urbana-Champaign Et tværfagligt team fra University of Illinois i Urbana-Champaign (UIUC) har demonstreret et stor
Automatisk syntese giver mulighed for opdagelse af uventet ladningstransportadfærd i organiske mole…Automatiseret synteseplatform i Molecule Marker Lab. Kredit:University of Illinois Urbana-Champaign Et tværfagligt team fra University of Illinois i Urbana-Champaign (UIUC) har demonstreret et stor -
 Slip sukkeret! En værdifuld byggesten til fremstilling af produkter af madaffaldKredit:CENER Næsten halvdelen af det, vi smider, er organisk affald - bananskind, et par rester ... De fleste byer indsamler denne type affald adskilt fra husholdninger. Men meget få byer gør go
Slip sukkeret! En værdifuld byggesten til fremstilling af produkter af madaffaldKredit:CENER Næsten halvdelen af det, vi smider, er organisk affald - bananskind, et par rester ... De fleste byer indsamler denne type affald adskilt fra husholdninger. Men meget få byer gør go -
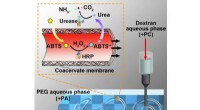 Materialeforskere bygger et syntetisk system med rum som rigtige cellerUMass Amherst materialeforsker Thomas Russell og andre beskriver i et nyt papir, hvordan de drager fordel af forskelle i elektrisk ladning til at skabe en alt vandig, vand-i-vand-konstruktion, der opn
Materialeforskere bygger et syntetisk system med rum som rigtige cellerUMass Amherst materialeforsker Thomas Russell og andre beskriver i et nyt papir, hvordan de drager fordel af forskelle i elektrisk ladning til at skabe en alt vandig, vand-i-vand-konstruktion, der opn
- Hvordan analiseres stjerner?
- Hvordan menneskelig urin kan forstyrre jordens sundhed og vandkvaliteten
- Sådan beregnes hastighed fra temperatur
- Forskere anvender anti-de Sitter/konform feltteorien til kosmologi
- Virkningerne af olieforurening på akvatiske økosystemer
- Sorte huller:en model for superledere?


