Hvad er opløsningsmiddelegenskaber?
Udtrykket "opløsningsmiddelegenskaber" henviser til et stofs et stof (opløsningsmidlet) til at opløse et andet stof (opløstelsen) og danne en homogen blanding kaldet en opløsning .
Her er en sammenbrud af nøglekoncepter:
opløsningsmiddel: Det stof, der opløser opløsningen. Normalt til stede i større mængder.
opløst: Det stof, der opløses af opløsningsmidlet.
Løsning: Den homogene blanding dannet, når opløsningen opløses i opløsningsmidlet.
Faktorer, der påvirker opløsningsmiddelegenskaber:
* Polaritet: Opløsningsmidler opløser opløste stoffer med lignende polaritet.
* polære opløsningsmidler Ligesom vand (H₂O) opløses polære opløste stoffer som sukker (c₁₂h₂₂o₁₁).
* Ikke-polære opløsningsmidler Ligesom olie (c₁₆h₃₄) opløses ikke-polære opløste stoffer som fedt (c₁₇h₃₅cooh).
* Temperatur: Højere temperatur øger generelt opløseligheden af faste stoffer og gasser i væsker.
* tryk: Tryk påvirker hovedsageligt opløseligheden af gasser i væsker. Forøget tryk fører til højere opløselighed.
* Intermolekylære kræfter: Stærkere intermolekylære kræfter mellem opløsningsmiddel og opløst molekyler fremmer bedre opløselighed.
* molekylær størrelse og form: Større molekyler med komplekse former har en tendens til at være mindre opløselige end mindre, enklere molekyler.
Hvorfor er opløsningsmiddelegenskab vigtig?
Opløsningsmiddelegenskaber er afgørende inden for forskellige felter:
* Kemi: Til udførelse af kemiske reaktioner, adskillelse af blandinger og rensende stoffer.
* biologi: Til transport af næringsstoffer og affaldsprodukter i levende organismer.
* Farmakologi: Til opløst medicin og levering af dem til kroppen.
* Industri: Til rengøring, ekstraktion og fremstillingsprocesser.
Eksempler på opløsningsmiddelegenskaber i handling:
* vandopløsende salt: Vand (polær opløsningsmiddel) opløses salt (ionisk forbindelse) på grund af tiltrækningen mellem vandmolekyler og ioner i salt.
* Olieopløsende fedt: Olie (ikke-polær opløsningsmiddel) opløser fedt (ikke-polær forbindelse), fordi de begge har lignende intermolekylære kræfter.
* kuldioxidopløsning i soda: Øget tryk i sodavlasker tvinger kuldioxid (gas) til at opløses i væsken, hvilket giver fizziness.
Forståelse af opløsningsmiddelegenskaber er afgørende for at forstå, hvordan forskellige stoffer interagerer og danner løsninger, der spiller en vigtig rolle i mange videnskabelige og daglige processer.
Sidste artikelHvilke reaktanter er involveret i fotosyntesen?
Næste artikelHvorfor er et almindeligt atomneutral?
 Varme artikler
Varme artikler
-
 Æteriske olier genopretter insekticidens effektivitet mod væggelusVæggelus er blevet stadig mere resistente over for visse klasser af syntetiske pesticider. Forskere fra Purdue University har afdækket mekanismer, der gør plantebaserede æteriske olier dødelige for væ
Æteriske olier genopretter insekticidens effektivitet mod væggelusVæggelus er blevet stadig mere resistente over for visse klasser af syntetiske pesticider. Forskere fra Purdue University har afdækket mekanismer, der gør plantebaserede æteriske olier dødelige for væ -
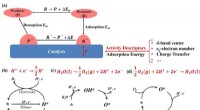 Aktivitetsbeskrivelser for elektrokatalysatorer i energilagringsapplikationer(a) Forskellige aktivitetsdeskriptorer for elektrokemiske reaktioner og katalytiske cyklusser af (b) hydrogenudviklingsreaktion, (c) oxygenudviklingsreaktion og (d) oxygenreduktionsreaktion i brændsel
Aktivitetsbeskrivelser for elektrokatalysatorer i energilagringsapplikationer(a) Forskellige aktivitetsdeskriptorer for elektrokemiske reaktioner og katalytiske cyklusser af (b) hydrogenudviklingsreaktion, (c) oxygenudviklingsreaktion og (d) oxygenreduktionsreaktion i brændsel -
 Forskere indser homogenisering af overfladeaktive steder af heterogen katalysatorKredit:Unsplash/CC0 Public Domain For nylig, et team ledet af professor Wu Changzheng fra School of Chemistry and Materials Science fra University of Science and Technology of China (USTC) i samar
Forskere indser homogenisering af overfladeaktive steder af heterogen katalysatorKredit:Unsplash/CC0 Public Domain For nylig, et team ledet af professor Wu Changzheng fra School of Chemistry and Materials Science fra University of Science and Technology of China (USTC) i samar -
 Nær-infrarød sonde afkoder telomerdynamikEn fluorescerende forbindelse blev knyttet til PIPet, der er målrettet mod den gentagne DNA -sekvens, der findes i telomerer. Denne sonde, kaldet SiR-TTet59B, muliggør observation af telomerer i aktio
Nær-infrarød sonde afkoder telomerdynamikEn fluorescerende forbindelse blev knyttet til PIPet, der er målrettet mod den gentagne DNA -sekvens, der findes i telomerer. Denne sonde, kaldet SiR-TTet59B, muliggør observation af telomerer i aktio


