Hvad betyder ikke -polært molekyle?
* Molekylet er symmetrisk: Fordelingen af elektroner er jævn, hvilket betyder, at der ikke er nogen områder med en højere koncentration af negativ ladning (elektroner).
* Molekylet indeholder kun ikke -polære bindinger: Dette er bindinger mellem atomer med lignende elektronegativitet, hvilket betyder, at de deler elektroner lige.
Nøgleegenskaber for ikke -polære molekyler:
* opløs ikke i vand: Vand er et polært molekyle, og "som opløses som." Ikke -polære molekyler tiltrækkes ikke af vandmolekyler og blandes derfor ikke.
* har svage intermolekylære kræfter: Disse kræfter er ansvarlige for at holde molekyler sammen. Da ikke -polære molekyler ikke har nogen opladningsadskillelse, er deres intermolekylære kræfter svage, hvilket fører til lavere kogepunkter og smeltepunkter.
* ofte hydrofobt: De har en tendens til at undgå vand og foretrækker at interagere med andre ikke -polære molekyler.
Eksempler på ikke -polære molekyler:
* kuldioxid (CO2): Den lineære form og symmetriske arrangement af iltatomer omkring carbonatomet resulterer i ingen netto ladningsadskillelse.
* methan (CH4): Den tetrahedrale form og lige deling af elektroner mellem kulstof- og hydrogenatomer gør det ikke -polært.
* olier og fedt: Disse er sammensat af lange kæder af ikke -polære kulbrinter.
I modsætning til ikke -polære molekyler har polære molekyler en adskillelse af ladning, hvilket resulterer i en positiv og negativ ende. Dette skaber et dipolmoment og gør dem mere tilbøjelige til at opløses i vand. Eksempler på polære molekyler inkluderer vand (H2O) og ethanol (C2H5OH).
Sidste artikelHvordan fremstilles ATP i lysreaktionerne?
Næste artikelHvad er hydrofobt, og hvordan bestemmer du, om et molekyle hydrofobt?
 Varme artikler
Varme artikler
-
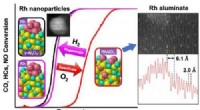 Fremtidige katalysatorer kan give mere valuta for pengeneGrafisk abstrakt. Kredit:Kemi af materialer (2022). DOI:10.1021/acs.chemmater.1c03513 Den næste generation af katalysatorer kan have længere levetid og har brug for færre sjældne materialer for at
Fremtidige katalysatorer kan give mere valuta for pengeneGrafisk abstrakt. Kredit:Kemi af materialer (2022). DOI:10.1021/acs.chemmater.1c03513 Den næste generation af katalysatorer kan have længere levetid og har brug for færre sjældne materialer for at -
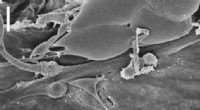 Molekylær volumenkontrolLarven Drosophila chordotonal organ set under scanningselektronmikroskopet. Denne sensoriske funktionelle enhed modulerer behandlingen af mekaniske stimuli ved hjælp af latrophilinreceptoren. Målest
Molekylær volumenkontrolLarven Drosophila chordotonal organ set under scanningselektronmikroskopet. Denne sensoriske funktionelle enhed modulerer behandlingen af mekaniske stimuli ved hjælp af latrophilinreceptoren. Målest -
 Højhastighedsfilmning afslører proteinændringer under fotosyntesenKredit:Göteborgs universitet Fotosyntese er den primære energikilde for næsten alt liv på jorden. En ny undersøgelse, udgivet i Natur , give ny indsigt i, hvordan evolution har optimeret de lysd
Højhastighedsfilmning afslører proteinændringer under fotosyntesenKredit:Göteborgs universitet Fotosyntese er den primære energikilde for næsten alt liv på jorden. En ny undersøgelse, udgivet i Natur , give ny indsigt i, hvordan evolution har optimeret de lysd -
 Brug af metaller til brændstofKredit:Pixabay/CC0 Public Domain Vidste du, at vi inden for mikrotyngdekraft forbereder et af de mest lovende brændstoffer til fremtiden? Mikrotyngdekraft hjælper med at finde svar og modeller ti
Brug af metaller til brændstofKredit:Pixabay/CC0 Public Domain Vidste du, at vi inden for mikrotyngdekraft forbereder et af de mest lovende brændstoffer til fremtiden? Mikrotyngdekraft hjælper med at finde svar og modeller ti
- Hvem opfandt øjeblikket størrelsesskala?
- Hvordan fungerer en Dippy Bird?
- Ny ultrahurtig metode til bestemmelse af antibiotikaresistens
- Energi fra solen rejser til jorden som hvilken slags energi?
- Hvilke kemikalier er ingredienser, der bruges i fotosyntesen?
- Sprinklere og drypvanding hjælper irakerne med at slå tørken


