Hvad gør vandmolekylet polært?
1. ulig deling af elektroner: Oxygen er mere elektronegativ end brint, hvilket betyder, at det tiltrækker elektroner stærkere. Dette får de delte elektroner i O-H-bindingerne til at tilbringe mere tid tættere på iltatomet.
2. bøjet molekylær geometri: De to hydrogenatomer er ikke placeret direkte overfor hinanden, men danner en bøjet form. Dette arrangement resulterer i en adskillelse af ladning inden for molekylet.
3. Delvis gebyrer: På grund af den ulige elektrondeling udvikler iltatomet en delvis negativ ladning (Δ-), og brintatomerne udvikler delvis positive ladninger (Δ+). Dette skaber et dipolmoment, hvor den ene ende af molekylet er lidt negativt, og den anden ende er lidt positiv.
her er en simpel analogi:
Forestil dig vandmolekylet som en lille magnet med en positiv pol og en negativ pol. Oxygenatomet virker som den negative pol og tiltrækker de positive ender af andre polære molekyler, mens brintatomerne fungerer som den positive pol og tiltrækker de negative ender.
Denne polaritet gør vand til et yderst effektivt opløsningsmiddel, så det kan opløse mange andre polære stoffer. Det bidrager også til vandets høje kogepunkt, overfladespænding og evne til at danne brintbindinger.
 Varme artikler
Varme artikler
-
 Den universelle sandhed om klæbrige overfladerEn bedre forståelse af rensningsopsætninger vil hjælpe materialeforskere med at udvikle bedre filtreringssystemer. Kredit:Panther Media GmbH / Alamy Det bliver nemmere at fange molekyler på specia
Den universelle sandhed om klæbrige overfladerEn bedre forståelse af rensningsopsætninger vil hjælpe materialeforskere med at udvikle bedre filtreringssystemer. Kredit:Panther Media GmbH / Alamy Det bliver nemmere at fange molekyler på specia -
 Ingeniører rapporterer om en ny metode til at producere nye fleksible LCD-skærmeOpdagelsen af RUDN-ingeniører vil hjælpe med at gøre fleksible og skabe 3D-billeder. Kredit:Allen Dressen RUDN-ingeniører har opdaget stoffer til at forenkle produktionen af fleksible LCD-skær
Ingeniører rapporterer om en ny metode til at producere nye fleksible LCD-skærmeOpdagelsen af RUDN-ingeniører vil hjælpe med at gøre fleksible og skabe 3D-billeder. Kredit:Allen Dressen RUDN-ingeniører har opdaget stoffer til at forenkle produktionen af fleksible LCD-skær -
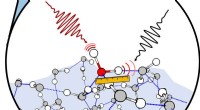 Kemikere ser nærmere på stedet, hvor vand møder luftSkematisk vandoverflade, hvor den spektrale signatur af et isotopisk mærket vandmolekyle er isoleret med to infrarøde lasere. Kredit:Nan Yang Vand, på trods af dens centrale plads i så mange proce
Kemikere ser nærmere på stedet, hvor vand møder luftSkematisk vandoverflade, hvor den spektrale signatur af et isotopisk mærket vandmolekyle er isoleret med to infrarøde lasere. Kredit:Nan Yang Vand, på trods af dens centrale plads i så mange proce -
 Big data-teknik afslører hidtil ukendte muligheder for almindelige materialerKredit:CC0 Public Domain Når forskere og ingeniører opdager nye måder at optimere eksisterende materialer på, det baner vejen for innovationer, der gør alt fra vores telefoner og computere til vor
Big data-teknik afslører hidtil ukendte muligheder for almindelige materialerKredit:CC0 Public Domain Når forskere og ingeniører opdager nye måder at optimere eksisterende materialer på, det baner vejen for innovationer, der gør alt fra vores telefoner og computere til vor
- Hvad er variablerne i et videnskabeligt eksperiment?
- Hvordan bruger vi elektricitet?
- Stort jordskælv rammer det nordlige Japan, efterlader 9 døde, 30 mangler
- Mini Mercury springer hen over solens store blænding i sjældne transit
- Navn på job for en organisme?
- Spørgsmål om dækning plager bredbåndsudvidelse i landdistrikterne


