Forklar, hvorfor vand undertiden kaldes det universelle opløsningsmiddel?
1. Polaritet: Vandmolekyler er polære, hvilket betyder, at de har en lidt positiv ende (hydrogenatomerne) og en lidt negativ ende (iltatomet). Denne polaritet giver vandmolekyler mulighed for at tiltrække og interagere med andre polære molekyler, såsom sukkerarter og salte.
2. Hydrogenbinding: De stærke hydrogenbindinger, der dannes mellem vandmolekyler, skaber en sammenhængende kraft, der kan bryde bindingerne, der holder andre molekyler sammen. Dette gør det muligt for vand at opløse mange ioniske forbindelser, som salte, ved at adskille deres positivt og negativt ladede ioner.
3. Høj dielektrisk konstant: Vand har en høj dielektrisk konstant, hvilket betyder, at det svækker de elektrostatiske kræfter mellem ioner, hvilket gør det lettere for dem at adskille og opløses.
4. Universelt opløsningsmiddel - ikke helt! Mens vand er et fremragende opløsningsmiddel, er det vigtigt at bemærke, at det ikke virkelig er universelt. Nogle stoffer, som fedt og olier, er ikke-polære og opløses ikke godt i vand.
Her er en analogi: Forestil dig vand som festværten. Det kan interagere med mange forskellige gæster (molekyler) og bringe dem sammen i en løsning. Det kan dog ikke altid komme sammen med alle.
Kortfattet: Vands unikke egenskaber, inklusive dets polaritet, hydrogenbinding og høj dielektrisk konstant, gør det til et usædvanligt effektivt opløsningsmiddel for en lang række stoffer. Denne evne har dybe konsekvenser for livet, da vand spiller en vigtig rolle i utallige biologiske processer.
Sidste artikelHvad syntetiseres i fotosyntesen fra sol plus vand og kuldioxid?
Næste artikelHvilke typer bindinger forbinder aminosyrer?
 Varme artikler
Varme artikler
-
 At bringe den grønne revolution til elektronikKredit:CC0 Public Domain Forskere undersøger, hvordan man laver elektroniske komponenter fra miljøvenlige, biologisk nedbrydelige materialer for at hjælpe med at løse et voksende folkesundheds- og
At bringe den grønne revolution til elektronikKredit:CC0 Public Domain Forskere undersøger, hvordan man laver elektroniske komponenter fra miljøvenlige, biologisk nedbrydelige materialer for at hjælpe med at løse et voksende folkesundheds- og -
 Ammoniaksyntese - den største innovation i det 20. århundredeTilpasning af de innovationstrin, der er involveret i ammoniaksyntese. Kredit:A. Barona et al./ Sci. Eng. Etik (fotos fra Archiv der Max-Planck-Gesellschaft, Berlin Udover at være et velkendt reng
Ammoniaksyntese - den største innovation i det 20. århundredeTilpasning af de innovationstrin, der er involveret i ammoniaksyntese. Kredit:A. Barona et al./ Sci. Eng. Etik (fotos fra Archiv der Max-Planck-Gesellschaft, Berlin Udover at være et velkendt reng -
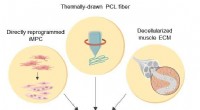 Biokonstrueret hybrid muskelfiber til regenerativ medicinSkematisk illustration af de 3D-skeletmuskellignende biomanipulerede konstruktioner Kredit:Institut for Grundvidenskab Muskler udgør det største organ hos mennesker, tegner sig for 40% af kropsmas
Biokonstrueret hybrid muskelfiber til regenerativ medicinSkematisk illustration af de 3D-skeletmuskellignende biomanipulerede konstruktioner Kredit:Institut for Grundvidenskab Muskler udgør det største organ hos mennesker, tegner sig for 40% af kropsmas -
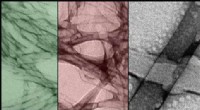 Formskiftende materialer:Brug af lys til at omarrangere makroskopiske strukturerTEM-billeder af selvsamlende nanostrukturer og deres rekombinationer, i falske farver. Kredit:Okinawa Institute of Science and Technology Graduate University - OIST OIST-forskere skaber selvsamlen
Formskiftende materialer:Brug af lys til at omarrangere makroskopiske strukturerTEM-billeder af selvsamlende nanostrukturer og deres rekombinationer, i falske farver. Kredit:Okinawa Institute of Science and Technology Graduate University - OIST OIST-forskere skaber selvsamlen
- Suns -energien når jorden ved hvilken type varmeoverførsel?
- Ionisk defekt landskab i perovskit solceller afsløret
- EU-lovgivere ønsker at reducere bilers emissioner med 40 procent inden 2030
- Politisk videnskabsmand beskriver stigningen i negativ partiskhed, og hvordan det driver vælgerne
- Hvilken måne -mission brændte op i atmosfæren?
- Hvorfor Wall Streets bekymrede sig om Tesla


