Hvordan ville egenskaber som et opløst ændringer, hvis stabilt vandmolekyle var H3O snarere end H2O?
1. Aciditet og pH:
* Øget surhedsgrad: H3O+ er hydroniumionen, som er den sure art i vand. Et stabilt H3O -molekyle ville betyde, at selve vandet i sig selv er surt med en meget lavere pH end den aktuelle neutrale pH på 7.
* påvirkning på opløste stoffer: Den øgede surhed ville påvirke opløseligheden og reaktiviteten af mange opløste stoffer:
* syrer: Svage syrer ville være meget mindre tilbøjelige til at donere protoner, da vandet allerede er stærkt surt.
* baser: Baser reagerede lettere med de overskydende hydroniumioner, hvilket førte til en højere grad af ionisering.
* amfoteriske stoffer: Opførslen af amfoteriske stoffer (som aminosyrer) ville blive forskudt mod deres sure natur.
2. Polaritet og hydrogenbinding:
* Forbedret polaritet: H3O+ har en større positiv ladning end H2O, hvilket gør molekylet endnu mere polært.
* stærkere hydrogenbinding: Den øgede polaritet ville føre til stærkere brintbindinger mellem H3O -molekyler og mellem H3O og andre polære opløste stoffer.
3. Opløselighed:
* påvirkning af ioniske forbindelser: Den højere polaritet og stærkere hydrogenbinding ville sandsynligvis øge opløseligheden af ioniske forbindelser, da de lettere opløses af de polære H3O -molekyler.
* påvirkning af ikke -polære forbindelser: Opløseligheden af ikke -polære forbindelser, såsom olier og fedt, vil sandsynligvis falde. Dette skyldes, at den stærke hydrogenbinding i H3O ville gøre det mindre sandsynligt, at det interagerer positivt med ikke -polære molekyler.
4. Kemiske reaktioner:
* øgede reaktionshastigheder: Den højere surhedsgrad og stærkere hydrogenbinding kan føre til øgede hastigheder for mange kemiske reaktioner, især dem, der involverer protonoverførsel eller hydrogenbindingsinteraktioner.
5. Biologiske implikationer:
* dramatisk indflydelse på livet: De grundlæggende ændringer i surhed og polaritet ville have dybtgående indflydelse på livet. Cellulære processer, der afhænger af specifikke pH -intervaller, ville blive alvorligt forstyrret. Enzymer og proteiner vil sandsynligvis miste deres funktionalitet, og biologiske membraner ville blive destabiliseret.
Konklusion:
Hvis vandmolekyler var stabilt H3O, ville vandets egenskaber være drastisk forskellige, hvilket påvirker opførelsen af opløste stoffer og selve livets natur, som vi kender det. Den øgede surhed, stærkere polaritet og ændret hydrogenbinding ville ændre det kemiske miljø markant og skabe en meget anden verden.
Sidste artikelHvilke organiske forbindelser er alle kroppe lavet af?
Næste artikelHvordan påvirker temperatur og pH funktionen af enzym?
 Varme artikler
Varme artikler
-
 Strategien foreslår måder at forberede sig på nye antibiotika-resistente superbugsBakterier udplades i petriskåle i Gautam Dantas laboratorium på Washington University School of Medicine i St. Louis. Dantas og hans kolleger har identificeret forbindelser, der blokerer resistens ove
Strategien foreslår måder at forberede sig på nye antibiotika-resistente superbugsBakterier udplades i petriskåle i Gautam Dantas laboratorium på Washington University School of Medicine i St. Louis. Dantas og hans kolleger har identificeret forbindelser, der blokerer resistens ove -
 Kemikere skaber vedvarende plantebaserede polymererMekanisk behandling af mitranol-baserede polymerer:a - primær polymer som hvidt pulver; b - smeltet polymer, c-f - forskellige former for polymeren efter at være blevet smeltet gentagne gange. Kredit:
Kemikere skaber vedvarende plantebaserede polymererMekanisk behandling af mitranol-baserede polymerer:a - primær polymer som hvidt pulver; b - smeltet polymer, c-f - forskellige former for polymeren efter at være blevet smeltet gentagne gange. Kredit: -
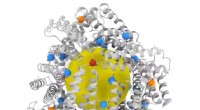 Nye bure for at fange molekyler skubber grænserne for proteindesignProteindesign er et populært og hurtigt voksende felt, med forskere, der konstruerer nye proteinbure-kapsellignende nanostrukturer til formål som genterapi og målrettet lægemiddellevering. Mange af di
Nye bure for at fange molekyler skubber grænserne for proteindesignProteindesign er et populært og hurtigt voksende felt, med forskere, der konstruerer nye proteinbure-kapsellignende nanostrukturer til formål som genterapi og målrettet lægemiddellevering. Mange af di -
 Forskere etablerer ny måde at teste for lægemiddelresistente infektionerForskerholdet arbejder nu med klinikere på York Teaching Hospital NHS Foundation Trust for at integrere dette modificerede antibiotikum i en hurtig diagnostisk test for antimikrobiel resistens ved uri
Forskere etablerer ny måde at teste for lægemiddelresistente infektionerForskerholdet arbejder nu med klinikere på York Teaching Hospital NHS Foundation Trust for at integrere dette modificerede antibiotikum i en hurtig diagnostisk test for antimikrobiel resistens ved uri
- Hvad gør elektroner?
- Nanoelektronik kunne få et løft fra kulstofforskning
- UV-sansende protein i hjernen i et marine annelid zooplankton
- Beskriv, hvordan energien ændrer sig fra en anvendelig form til mindre i varmesystemet?
- Hvordan kan bevægelsen af et objekt, der bevæger sig, ændre sig?
- Opdagelsen af et nyt køretøjspeptid åbner en rute til levering af lægemidler


