Organiske forbindelser er også kovalente, hvilke egenskaber ville du forvente, at organiske vil have som et resultat?
1. Lavere smelte- og kogepunkter:
* Årsag: Kovalente bindinger er relativt svage sammenlignet med ioniske bindinger. Dette betyder, at der kræves mindre energi for at bryde dem, hvilket fører til lavere smelte- og kogepunkter. Mange organiske forbindelser er væsker eller gasser ved stuetemperatur.
2. Uopløselighed i vand (generelt):
* Årsag: Vand er et polært molekyle (med en positiv og negativ ende). Organiske forbindelser på grund af deres for det meste kulstof-hydrogenbindinger er ofte ikke-polære eller kun let polære. "Som opløser som", så blandes ikke let med polært vand.
3. Lammbarhed:
* Årsag: Mange organiske forbindelser indeholder en høj andel af kulstof og brint. Disse elementer danner let kuldioxid og vand ved forbrænding og frigiver energi (varme) i processen.
4. Fleksibilitet og variation:
* Årsag: Carbons evne til at danne fire kovalente bindinger giver mulighed for en lang række strukturer og former, fra enkle kæder til komplekse ringe og forgrenede molekyler. Denne fleksibilitet giver anledning til den enorme mangfoldighed af organiske forbindelser.
5. Reaktivitet:
* Årsag: Mens kovalente bindinger generelt er stærke, kan organiske forbindelser gennemgå forskellige reaktioner. Tilstedeværelsen af funktionelle grupper (specifikke arrangementer af atomer) påvirker deres reaktivitet. For eksempel er dobbeltbindingerne i alkener mere reaktive end de enkelte bindinger i alkaner.
6. Isolatorer:
* Årsag: Kovalente bindinger tillader ikke den frie bevægelse af elektroner, hvilket gør organiske forbindelser generelt dårlige ledere af elektricitet. Dette er grunden til, at mange plast og polymerer bruges som elektriske isolatorer.
7. Bionedbrydelighed:
* Årsag: De kovalente bindinger i organiske forbindelser kan opdeles af mikroorganismer, hvilket fører til deres nedbrydning. Dette gør mange organiske materialer bionedbrydeligt, en gavnlig ejendom med hensyn til miljøpåvirkning.
Eksempler:
* methan (CH4): En enkel, ikke -polær gas med et lavt kogepunkt.
* ethanol (C2H5OH): En polær organisk forbindelse, der i en vis grad kan opløses i vand.
* polyethylen (C2H4) N: En langkædede polymer, der bruges til plastposer og flasker, kendt for sin fleksibilitet og isolerende egenskaber.
Vigtig note: Selvom dette er generelle tendenser, er der undtagelser fra enhver regel. Nogle organiske forbindelser er ret polære og opløselige i vand. Nogle er meget stabile og modstandsdygtige over for nedbrydning. Kompleksiteten af organisk kemi ligger i at forstå de specifikke egenskaber ved individuelle forbindelser baseret på deres strukturer og funktionelle grupper.
Sidste artikelForklar forskellen mellem opløsningsmidler og opløste stoffer?
Næste artikelHvor kan molekyler findes?
 Varme artikler
Varme artikler
-
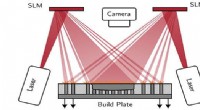 Holografisk stråleformning for at give et boost til metallisk 3-D-printAfdelingens set-up for additiv fremstilling (AM). Kredit:Peter Christopher Cambridge ingeniører har påbegyndt et treårigt forskningsprogram for at hjælpe med at fremskynde fremstillingen af meta
Holografisk stråleformning for at give et boost til metallisk 3-D-printAfdelingens set-up for additiv fremstilling (AM). Kredit:Peter Christopher Cambridge ingeniører har påbegyndt et treårigt forskningsprogram for at hjælpe med at fremskynde fremstillingen af meta -
 Den schweiziske hærkniv af røgskærmeEn ny type røggranat, der kan skjule sensorer i det synlige og infrarøde område, brænder under en test. Kredit:US Army At udløse røgbomber er mere end god fornøjelse den fjerde juli. Militæret bru
Den schweiziske hærkniv af røgskærmeEn ny type røggranat, der kan skjule sensorer i det synlige og infrarøde område, brænder under en test. Kredit:US Army At udløse røgbomber er mere end god fornøjelse den fjerde juli. Militæret bru -
 Halvlederchip, der detekterer udåndet gas med høj følsomhed ved stuetemperaturIoT kemisk sensor, der registrerer små mængder gasmolekyler, der er adsorberet på overfladen af det tynde nanosheet Kredit:Toyohashi University of Technology. Tredjeårs doktorand Toshiaki Takaha
Halvlederchip, der detekterer udåndet gas med høj følsomhed ved stuetemperaturIoT kemisk sensor, der registrerer små mængder gasmolekyler, der er adsorberet på overfladen af det tynde nanosheet Kredit:Toyohashi University of Technology. Tredjeårs doktorand Toshiaki Takaha -
 Stemplet, espresso, filter? Bare fordi din kaffe er bitter, betyder det ikke, at den er stærkereMoka-gryden, en anden ikonisk italiensk opfindelse, brygger kaffe ved høje temperaturer på en komfur. Kredit:Ccu.bat/Shutterstock Kaffe – en bønne med mange muligheder. Et stort valg er, hvordan ma
Stemplet, espresso, filter? Bare fordi din kaffe er bitter, betyder det ikke, at den er stærkereMoka-gryden, en anden ikonisk italiensk opfindelse, brygger kaffe ved høje temperaturer på en komfur. Kredit:Ccu.bat/Shutterstock Kaffe – en bønne med mange muligheder. Et stort valg er, hvordan ma
- Hvad er HCH -bindingsvinklen for methanol?
- 13 Hvilken struktur andetsteds i skeletsystemet har en og funktion, der ligner acetabular labrum af …
- Hvordan fungerer planteceller?
- Laserfabrikerede krystaller i glas er ferroelektriske
- I en testkørsel accelererer visse biler ensartet fra nul til 24 meter i sekundet i 2,95S Hvad er st…
- Et nyt blik på uordnet kulstof


