Beskriv bindingen i et vandmolekyle?
1. Kovalente obligationer:
* inden for molekylet: Hvert hydrogenatom deler sin enkle elektron med iltatomet og danner en enkelt kovalent binding. Denne deling af elektroner skaber et stabilt molekyle.
* Polaritet: Oxygen er mere elektronegativ end brint, hvilket betyder, at det tiltrækker de delte elektroner stærkere. Dette skaber en delvis negativ ladning (Δ-) på iltatomet og en delvis positiv ladning (Δ+) på hvert hydrogenatom. Dette gør vandmolekylet polært.
2. Intermolekylære kræfter:
* Hydrogenbindinger: Den stærke polaritet af vandmolekylet fører til hydrogenbinding. De delvist positive hydrogenatomer på et vandmolekyle tiltrækkes af det delvist negative iltatom på et andet vandmolekyle. Disse hydrogenbindinger er relativt stærke intermolekylære kræfter, der er ansvarlige for mange af vandets unikke egenskaber.
* van der Waals Forces: Mens svagere end hydrogenbindinger, spiller disse midlertidige, svingende kræfter også en rolle i samspillet mellem vandmolekyler.
Sammendrag:
* Vandmolekylet holdes sammen af kovalente bindinger mellem ilt- og brintatomer.
* Den polære karakter af vandmolekylet resulterer i hydrogenbinding mellem molekyler, hvilket gør vand til et meget sammenhængende og alsidigt stof.
Konsekvenser af denne binding:
* Højt kogepunkt: Hydrogenbindinger kræver en masse energi til at bryde, hvilket fører til vandets relativt høje kogepunkt.
* Godt opløsningsmiddel: Water's polaritet giver det mulighed for at opløse mange polære stoffer og tjene det titlen "universal opløsningsmiddel".
* overfladespænding: De stærke hydrogenbindinger skaber overfladespænding, hvilket gør det muligt for vand at danne dråber.
Denne kombination af kovalent binding og stærke intermolekylære kræfter gør vand til et unikt og essentielt molekyle for livet på jorden.
Sidste artikelReaktionstiden i en laboratorieindstilling er anden?
Næste artikelHvorfor er dannelse af anion eksoterm?
 Varme artikler
Varme artikler
-
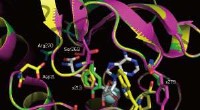 Direkte udvikling for at designe enzymer, der laver billeddannelsesmidler til medicinsk diagnoseEt nærbillede af SAM-bindingsstederne for det native enzym (gul) og to mutanter (magenta og grøn). De muterede positioner 213 og 279 er mærket. Kredit:WILEY-VCH Verlag GmbH &Co. KGaA, Weinheim Org
Direkte udvikling for at designe enzymer, der laver billeddannelsesmidler til medicinsk diagnoseEt nærbillede af SAM-bindingsstederne for det native enzym (gul) og to mutanter (magenta og grøn). De muterede positioner 213 og 279 er mærket. Kredit:WILEY-VCH Verlag GmbH &Co. KGaA, Weinheim Org -
 Carbon black genanvendes fra bildækTop, primærprodukt fra venstre til højre:rå rCB, ren rCB (96+), ren rCB med perler (96+). Bund, sekundære produkter genvundet fra asken, fra venstre til højre:flydende natriumsilicat eller vandglas, u
Carbon black genanvendes fra bildækTop, primærprodukt fra venstre til højre:rå rCB, ren rCB (96+), ren rCB med perler (96+). Bund, sekundære produkter genvundet fra asken, fra venstre til højre:flydende natriumsilicat eller vandglas, u -
 Hvordan man bygger kunstige nanofabrikker til at drive vores fremtidSkibe hjælper med at håndtere den komplekse logistik for at levere produkter til forbrugerne. Fremtidige kunstige nanofabrikker vil også have brug for en kæde af logistiske nano-køretøjer til at lever
Hvordan man bygger kunstige nanofabrikker til at drive vores fremtidSkibe hjælper med at håndtere den komplekse logistik for at levere produkter til forbrugerne. Fremtidige kunstige nanofabrikker vil også have brug for en kæde af logistiske nano-køretøjer til at lever -
 Billeddannelse af strukturelle ændringer i katalysatorer under reaktionsbetingelserFigur (til venstre) viser den opsætning, der bruges til at fange reversible transformationer i Palladium (Pd) nanopartikler under carbonmonoxid (CO) oxidationsreaktion med operando transmission elektr
Billeddannelse af strukturelle ændringer i katalysatorer under reaktionsbetingelserFigur (til venstre) viser den opsætning, der bruges til at fange reversible transformationer i Palladium (Pd) nanopartikler under carbonmonoxid (CO) oxidationsreaktion med operando transmission elektr
- Hvad er nettokraften på en 2,0 N og en 3,0, der virker på objekt i samme retning?
- Ytterbium:Morgendagens kvantehukommelse
- Har afstand påvirker solstrålingen, som planeten modtager?
- Hvad er valens for osmium?
- Hvordan fungerer spindevandsrammen?
- Konstruerede mikrober kan producere bionedbrydeligt plast til lavere omkostninger og miljøpåvirkni…


