Direkte udvikling for at designe enzymer, der laver billeddannelsesmidler til medicinsk diagnose
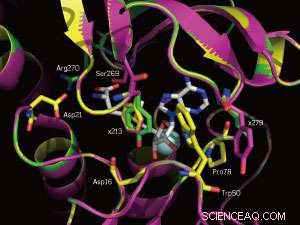
Et nærbillede af SAM-bindingsstederne for det native enzym (gul) og to mutanter (magenta og grøn). De muterede positioner 213 og 279 er mærket. Kredit:WILEY-VCH Verlag GmbH &Co. KGaA, Weinheim
Organiske molekyler indeholdende et fluoratom er meget udbredt i materialerne, landbrugskemiske og farmaceutiske industrier. Imidlertid, syntetisering af carbon-fluor-bindingen anvender typisk giftige metalkatalysatorer og kræver vandfrie betingelser og høje temperaturer. Nu har et internationalt team udviklet et mildere, mere effektiv enzymbaseret tilgang til at skabe denne binding.
Denne enzymatiske metode fungerer under vandige forhold og ved milde temperaturer og blev udviklet af et konsortium, der omfattede forskere fra A*STAR og andre institutioner. "Disse forhold er virkelig meget attraktive, "forklarer teammedlem Yee Hwee Lim fra A*STAR Institute of Chemical and Engineering Sciences.
Holdet brugte et af de meget specifikke fluorinase-enzymer, der findes i naturen - FlA1. Disse enzymer katalyserer dannelsen af en kulstof-fluorbinding i S-adenosylmethionin (SAM) ved hjælp af uorganisk fluorid via en substitutionsmekanisme.
Enzymet, mens det er fremragende til at katalysere fluoreringsreaktioner med dette naturlige molekyle, fungerede ikke godt på ikke-naturlige molekyler. I øvrigt, bestræbelser på at ændre enzymernes strukturer og, dermed, funktion havde været en kamp - indtil nu.
"Vi viste for første gang, at fluorinaseenzymet kan konstrueres, og at konstruktionen kan forbedre sin enzymatiske aktivitet, selv på ikke-naturlige molekyler, "Siger Lim.
Holdet brugte den etablerede teknik kendt som 'dirigeret evolution', som efterligner naturlig selektion for at udvikle enzymer, så de kan reagere godt med ikke-naturlige molekyler.
"Direktiv evolution er aldrig blevet anvendt med succes på dette enzym, indtil nu, " siger Lim. "Dette er et svært enzym at arbejde med, og vi stod over for en masse udfordringer, herunder problemer med produktnedbrydning."
Holdet brugte radiomærkning af 5'-chlor-5'-deoxyadenosin (5'-CIDA) til at vise deres evner. I denne to-trins reaktion, radiomærket 5'-CIDA konverteres til SAM, og derefter fluoreret til dannelse af 5'-fluor-5'-deoxyadenosin (5'-FDA). Dette mærket 5'-FDA-produkt kan potentielt bruges til en medicinsk diagnoseprocedure kendt som positronemissionstomografi (PET).
"Vi viser, at forbedring af et enzyms aktivitet tre gange kan åbne op for flere applikationer, " siger Lim. "De native enzymer er tidligere blevet brugt til at prøve at mærke PET-midler, men reaktionstiderne var lange, nogle gange timer. Ved hjælp af vores enzym kunne vi udføre reaktionen på 30 minutter, en mere rimelig tidslinje, da Fluor-18s halveringstid er mindre end to timer. "
Lims team undersøger nu, hvordan mutation af enzymets struktur ændrer dets interaktion med 5'-CIDA og SAM. "Jeg vil gerne engagere beregningsbiologer for bedre at forstå mere om de mutationer, vi har foretaget, og hvordan disse korrelerer med vores reaktioner."
 Varme artikler
Varme artikler
-
 Forskere bruger lysfølsomme molekyler til at spore proteiner, der er kritiske for cellesignaleringForskere ved Rice University og UTHealth sporede konformationerne af proteiner, der står vagt ved transmembrane kanaler i nervecellernes vægge. I bunden af proteinerne på dette billede er fluorofore
Forskere bruger lysfølsomme molekyler til at spore proteiner, der er kritiske for cellesignaleringForskere ved Rice University og UTHealth sporede konformationerne af proteiner, der står vagt ved transmembrane kanaler i nervecellernes vægge. I bunden af proteinerne på dette billede er fluorofore -
 Stort skridt fremad i produktionen af grøn brintKredit:CC0 Public Domain Den første termodynamisk reversible kemiske reaktor, der er i stand til at producere brint som en ren produktstrøm, repræsenterer et transformationelt skridt fremad i den
Stort skridt fremad i produktionen af grøn brintKredit:CC0 Public Domain Den første termodynamisk reversible kemiske reaktor, der er i stand til at producere brint som en ren produktstrøm, repræsenterer et transformationelt skridt fremad i den -
 Grøn kemi skaber belægninger fra naturenLignocellulose biomasse krakkes ved hjælp af syre til fremstilling af furfural. Ved at bruge synligt lys og ilt, furfural omdannes til hydroxybutenolid, som derefter modificeres ved hjælp af forskelli
Grøn kemi skaber belægninger fra naturenLignocellulose biomasse krakkes ved hjælp af syre til fremstilling af furfural. Ved at bruge synligt lys og ilt, furfural omdannes til hydroxybutenolid, som derefter modificeres ved hjælp af forskelli -
 Kan aluminium opvarmes og bøjes?Aluminium (også stavet aluminium) er det mest rigelige metal på jorden og det tredje mest almindelige element generelt efter ilt og silicium. Som det er almindeligt for alle metaller, kan aluminium bø
Kan aluminium opvarmes og bøjes?Aluminium (også stavet aluminium) er det mest rigelige metal på jorden og det tredje mest almindelige element generelt efter ilt og silicium. Som det er almindeligt for alle metaller, kan aluminium bø
- Et meget lysabsorberende og afstembart materiale
- Våd vinter stopper ikke risikoen for klimaændringer for Colorado River
- Energirelaterede emissioner steg i december på trods af pandemi
- Angst over livestreams kan hjælpe os med at designe bedre Facebook- og YouTube-indholdsmoderering
- Sådan faktor Faktor Square Trinomials
- Forudsige, hvornår onlinesamtaler bliver giftige


