Hvilken egenskab ved vandmolekyler giver dem mulighed for at danne en brintbinding?
Her er hvorfor:
* Polaritet: Vandmolekyler er polære, hvilket betyder, at de har en ujævn fordeling af ladning. Oxygenatomet er mere elektronegativt end hydrogenatomerne, tiltrækker de delte elektroner og får en lidt negativ ladning. Hydrogenatomerne bliver lidt positive.
* Hydrogenbinding: Denne ujævne ladningsfordeling skaber et dipolmoment i vandmolekylet. De lidt positive hydrogenatomer i et vandmolekyle tiltrækkes af det lidt negative iltatom i et andet vandmolekyle, der danner en hydrogenbinding .
Denne hydrogenbinding er ansvarlig for mange af vandets unikke egenskaber, herunder:
* Højt kogepunkt: Hydrogenbindinger kræver mere energi til at bryde, hvilket fører til et højere kogepunkt.
* Høj overfladespænding: Hydrogenbindinger skaber en stærk sammenhængende kraft mellem vandmolekyler, hvilket resulterer i overfladespænding.
* Fremragende opløsningsmiddel: Water's polaritet giver det mulighed for at opløse mange polære molekyler, hvilket gør det til et godt opløsningsmiddel.
* Høj varmekapacitet: Vand kan absorbere en masse varme uden at ændre temperatur markant på grund af den energi, der er nødvendig for at bryde brintbindinger.
Så det er polariteten af vandmolekyler med deres lidt positive og negative regioner, der giver dem mulighed for at danne disse afgørende brintbindinger.
Sidste artikelHvad er deltaet af fotosynteseaktionen?
Næste artikelHvilke to typer molekyler er nødvendige for at danne et fedt molekyle?
 Varme artikler
Varme artikler
-
 Forskere bestemmer aktive steder af Cu-znO-katalysatorer til vandgasskift og CO-hydrogeneringsreakti…Fig. 1:Mikroskopiske karakteriseringer. Skalabjælkerne for (a1–a3), (d1-d3), og (e1–e3) svarer til 500 nm, det for b3 svarer til 100 nm, dem af b1, b2, c2, og c3 svarer til 50 nm, det for c1 svarer ti
Forskere bestemmer aktive steder af Cu-znO-katalysatorer til vandgasskift og CO-hydrogeneringsreakti…Fig. 1:Mikroskopiske karakteriseringer. Skalabjælkerne for (a1–a3), (d1-d3), og (e1–e3) svarer til 500 nm, det for b3 svarer til 100 nm, dem af b1, b2, c2, og c3 svarer til 50 nm, det for c1 svarer ti -
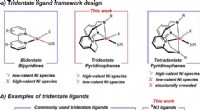 Nyt molekyle sætter scenen for nikkel som en grønnere fotokatalysator, afslører vigtige trin i re…et Tridentate ligandrammedesign. b Repræsentative tridentate N-donorligander, der almindeligvis anvendes til at stabilisere ualmindelige Ni-oxidationstilstande og RN3 tridentate ligander udviklet i de
Nyt molekyle sætter scenen for nikkel som en grønnere fotokatalysator, afslører vigtige trin i re…et Tridentate ligandrammedesign. b Repræsentative tridentate N-donorligander, der almindeligvis anvendes til at stabilisere ualmindelige Ni-oxidationstilstande og RN3 tridentate ligander udviklet i de -
 Undersøgelse afslører dynamisk adfærd af Cu-N-C enkeltatom-katalysator i elektrokatalyseKredit:CC0 Public Domain Atomisk dispergerede M-N-C (M refererer til overgangsmetaller) materialer betragtes som de mest lovende alternativer til de Pt-baserede ædelmetalkatalysatorer til elektrok
Undersøgelse afslører dynamisk adfærd af Cu-N-C enkeltatom-katalysator i elektrokatalyseKredit:CC0 Public Domain Atomisk dispergerede M-N-C (M refererer til overgangsmetaller) materialer betragtes som de mest lovende alternativer til de Pt-baserede ædelmetalkatalysatorer til elektrok -
 Forståelse af relaxor ferroelektriske egenskaber kan føre til mange fremskridtChirale (spejl) molekyler giver relaxor ferroelektriske stoffer deres fantastiske egenskaber. Kredit:MR, Penn State En ny grundlæggende forståelse af polymer relaxor ferroelektrisk adfærd kan føre
Forståelse af relaxor ferroelektriske egenskaber kan føre til mange fremskridtChirale (spejl) molekyler giver relaxor ferroelektriske stoffer deres fantastiske egenskaber. Kredit:MR, Penn State En ny grundlæggende forståelse af polymer relaxor ferroelektrisk adfærd kan føre
- Hvorfor er der en nedre grænse for den masse, som stjerne kan have?
- Kommer alle væv fra den samme embryonale oprindelse?
- Orkanen Douglas får styrke; skørter af staten Hawaii
- Hvad gør flammen lysende?
- Hvad ville en miljøgeogpher undersøgelse?
- Hvad er de tre typer af havbundsedimenter Terrigenous Biogenous og.?


