Diffunderer faste stoffer og væsker i samme hastighed?
* Partikelbevægelse: I faste stoffer er partikler tæt pakket og vibrerer i faste positioner. De har meget begrænset bevægelsesfrihed. I væsker er partikler tættere sammen end i gasser, men kan bevæge sig mere frit.
* Afstand mellem partikler: Rummet mellem partikler i væsker er meget større end i faste stoffer. Dette giver mulighed for lettere bevægelse og diffusion.
* Intermolekylære kræfter: De intermolekylære kræfter, der holder partikler sammen i væsker, er svagere end dem i faste stoffer. Dette muliggør lettere adskillelse og bevægelse.
Tænk på det på denne måde:
* Forestil dig et overfyldt rum fuld af mennesker (faste stoffer) - det ville være meget vanskeligt at bevæge sig rundt og blande med andre.
* Forestil dig nu en gruppe mennesker i en park (væsker) - de har meget mere plads til at bevæge sig rundt og blande sig.
Diffusion i faste stoffer: Diffusion i faste stoffer er en meget langsom proces, der typisk forekommer over lange perioder og ved høje temperaturer.
Diffusion i væsker: Diffusion i væsker er meget hurtigere end i faste stoffer. Det er grundlaget for mange hverdagsprocesser, som blanding af sukker i vand eller spredning af en dråbe madfarve i et glas vand.
Faktorer, der påvirker diffusion:
* Temperatur: Højere temperaturer øger partiklernes kinetiske energi, hvilket fører til hurtigere diffusion.
* Koncentrationsforskel: En større koncentrationsforskel mellem to regioner vil resultere i hurtigere diffusion.
* stoffet: Størrelsen, form og polaritet af molekyler kan påvirke, hvor hurtigt de diffunderer.
Fortæl mig, hvis du har andre spørgsmål!
Sidste artikelFormål med høj saltkoncentration i Mannitol Agar -mediet?
Næste artikelHvilke to produkter afgives under fotosyntesen?
 Varme artikler
Varme artikler
-
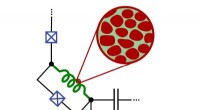 Granulært aluminium til fremtidige computereDen fluxonium-qubit, der indeholder granulært aluminium, kan forblive i en tilstand mellem 0 og 1 i en tid på op til 30 mikrosekunder (fig. Ioan Pop, SÆT) Computere baseret på kvantemekaniske prin
Granulært aluminium til fremtidige computereDen fluxonium-qubit, der indeholder granulært aluminium, kan forblive i en tilstand mellem 0 og 1 i en tid på op til 30 mikrosekunder (fig. Ioan Pop, SÆT) Computere baseret på kvantemekaniske prin -
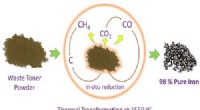 Træk jern ud af spildprintertonerKredit:American Chemical Society En skønne dag, rester af toner i kasserede printerpatroner kan have et nyt liv som bro eller bygningsdele i stedet for som skraldespand, spilde væk på lossepladser
Træk jern ud af spildprintertonerKredit:American Chemical Society En skønne dag, rester af toner i kasserede printerpatroner kan have et nyt liv som bro eller bygningsdele i stedet for som skraldespand, spilde væk på lossepladser -
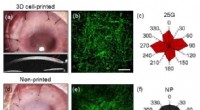 3D-trykte kunstige hornhinder ligner menneskeligeIn vivo (a-c) og in vitro (d-f) evalueringsresultater af 3D-celletrykte og ikke-trykte hornhindeimplantater. Optiske billeder fra spaltelampeundersøgelse, 2D tværsnits OCT-billeder (a, d), og SHG-bill
3D-trykte kunstige hornhinder ligner menneskeligeIn vivo (a-c) og in vitro (d-f) evalueringsresultater af 3D-celletrykte og ikke-trykte hornhindeimplantater. Optiske billeder fra spaltelampeundersøgelse, 2D tværsnits OCT-billeder (a, d), og SHG-bill -
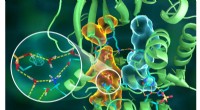 Neutroner maler atomportræt af prototypisk cellesignalingsenzymIllustration af den indviklede organisering af PKA -strukturen, hvor forskellige dele af proteinet er forbundet via udførlige hydrogenbindingsnetværk (stiplede gule linjer), limet sammen af de hydro
Neutroner maler atomportræt af prototypisk cellesignalingsenzymIllustration af den indviklede organisering af PKA -strukturen, hvor forskellige dele af proteinet er forbundet via udførlige hydrogenbindingsnetværk (stiplede gule linjer), limet sammen af de hydro


