Er vand sammensat af polære molekyler?
* struktur: Et vandmolekyle (H₂O) har to hydrogenatomer bundet til et iltatom. Oxygenatomet er mere elektronegativt end hydrogenatomerne, hvilket betyder, at det tiltrækker elektroner stærkere. Dette skaber en delvis negativ ladning (Δ-) på iltatomet og delvis positive ladninger (δ+) på hydrogenatomerne.
* form: Molekylet er bøjet med brintatomerne i en vinkel til iltatomet. Denne bøjede form forstærker den ujævne fordeling af ladninger, hvilket gør molekylet polær.
Polariteten af vandmolekyler er ansvarlig for mange af dens unikke egenskaber, herunder:
* Højt kogepunkt: De stærke hydrogenbindinger mellem vandmolekyler kræver en masse energi for at bryde, hvilket fører til et relativt højt kogepunkt.
* Godt opløsningsmiddel: Polære molekyler som vand kan opløse andre polære molekyler og ioniske forbindelser, hvilket gør vand til et fremragende opløsningsmiddel.
* overfladespænding: Den stærke tiltrækning mellem vandmolekyler skaber en høj overfladespænding, hvilket gør det muligt for ting som insekter at gå på vandet.
 Varme artikler
Varme artikler
-
 En laserdrevet programmerbar berøringsfri transfertrykteknik(A) Skematisk illustration af den laserdrevne programmerbare berøringsfri transfertrykproces via et aktivt elastomerisk mikrostruktureret stempel. (B) Udskrivning af enkelt Si-blodplade og LED-chip på
En laserdrevet programmerbar berøringsfri transfertrykteknik(A) Skematisk illustration af den laserdrevne programmerbare berøringsfri transfertrykproces via et aktivt elastomerisk mikrostruktureret stempel. (B) Udskrivning af enkelt Si-blodplade og LED-chip på -
 3-D-printharpikser i tandudstyr kan være giftige for reproduktiv sundhedKredit:CC0 Public Domain To kommercielt tilgængelige 3-D-printbare harpikser, som markedsføres som værende biokompatible til brug i dentale applikationer, let udvaskes forbindelser i deres omgivel
3-D-printharpikser i tandudstyr kan være giftige for reproduktiv sundhedKredit:CC0 Public Domain To kommercielt tilgængelige 3-D-printbare harpikser, som markedsføres som værende biokompatible til brug i dentale applikationer, let udvaskes forbindelser i deres omgivel -
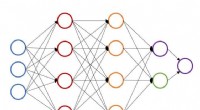 Accelererende geometrioptimering i molekylær simuleringIllustration af en enkelt neural netværksstruktur til forudsigelse af atomenergi. Kredit:John Kitchin, Carnegie Mellon University Maskinelæring, en dataanalysemetode, der bruges til at automatiser
Accelererende geometrioptimering i molekylær simuleringIllustration af en enkelt neural netværksstruktur til forudsigelse af atomenergi. Kredit:John Kitchin, Carnegie Mellon University Maskinelæring, en dataanalysemetode, der bruges til at automatiser -
 Hvordan stabilisering af forstyrrede proteiner kan føre til den næste generation af medicinske app…LCST IDPPer udviser en bred vifte af hysteretisk faseadfærd. (A) Analyse af den reversible faseadfærd af LCST IDPPer i vores bibliotek afslørede tre grupper af gentagne motiver, hvor motiver i hver gr
Hvordan stabilisering af forstyrrede proteiner kan føre til den næste generation af medicinske app…LCST IDPPer udviser en bred vifte af hysteretisk faseadfærd. (A) Analyse af den reversible faseadfærd af LCST IDPPer i vores bibliotek afslørede tre grupper af gentagne motiver, hvor motiver i hver gr
- Beskriv, hvordan solcellepanel bruges i generering af elektricitet?
- Hvad har bakterier til fælles med celler og andre levende organismer?
- Kvantevarmepumpe:Et nyt måleværktøj til fysikere
- Hvad er nettokraften på en dragster med masse på 900 kg, hvis dens acceleration 32,0 ms2 vest?
- Hvad er det videnskabelige ord for røv?
- En større fornyelse af SNAP kunne eliminere fødevareusikkerhed i USA.


