Hvor kommer den endelige elektron i indre overgangsmetaller ind?
Her er hvorfor:
* indre overgangsmetaller: Disse elementer er kendetegnet ved udfyldning af F -orbitaler, som er placeret inde i D -orbitaler og beskytter dem fra de ydre elektroner.
* 4f og 5f orbitaler: Disse orbitaler er de højeste energiniveauer, der er tilgængelige i de respektive perioder. Den endelige elektron kommer ind i disse orbitaler, hvilket fører til de unikke egenskaber ved disse elementer.
Eksempel:
* lanthanum (LA) , det første lanthanid, har sin endelige elektron, der kommer ind i 5D -orbitalen, men efterfølgende lanthanider fylder deres 4F -orbitaler.
* actinium (AC) , den første actinid, har sin endelige elektron, der kommer ind i 6D -orbitalen, men efterfølgende actinider fylder deres 5F -orbitaler.
Derfor går det endelige elektron i indre overgangsmetaller altid ind i f-subshell Det svarer til den periode, de er i.
 Varme artikler
Varme artikler
-
 Legeringssammensætninger kan påvirke partiklernes elektroniske tilstandeFigur. Spektralmålinger opnået ved hjælp af højopløsningsfotoelektronspektroskopi. I disse forsøg, hård røntgensynkrotronstråling blev påført prøvepartikler. (a) og (b) viser Rh 3d kerneniveauspektre,
Legeringssammensætninger kan påvirke partiklernes elektroniske tilstandeFigur. Spektralmålinger opnået ved hjælp af højopløsningsfotoelektronspektroskopi. I disse forsøg, hård røntgensynkrotronstråling blev påført prøvepartikler. (a) og (b) viser Rh 3d kerneniveauspektre, -
 Kunstige celler-i-celler udløst af lys fungerer som mini-kemiske reaktorerCircles in a Circle af Kandinsky. Kredit:Philadelphia Museum of Art, Louise og Walter Arensbergs Samling, 1950-134-104 Kunstige celler, der frigiver materialer, når de udsættes for lys, er blevet
Kunstige celler-i-celler udløst af lys fungerer som mini-kemiske reaktorerCircles in a Circle af Kandinsky. Kredit:Philadelphia Museum of Art, Louise og Walter Arensbergs Samling, 1950-134-104 Kunstige celler, der frigiver materialer, når de udsættes for lys, er blevet -
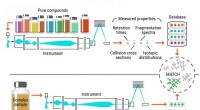 Ny tilgang til metabolomics-forskning kan vise sig at ændre spilletIllustration af den konventionelle identifikationsproces af metabolitter. Kredit:Pacific Northwest National Laboratory Nøjagtig identifikation af metabolitter, og andre små kemikalier, i biologisk
Ny tilgang til metabolomics-forskning kan vise sig at ændre spilletIllustration af den konventionelle identifikationsproces af metabolitter. Kredit:Pacific Northwest National Laboratory Nøjagtig identifikation af metabolitter, og andre små kemikalier, i biologisk -
 Udvikling af nye processer til at undersøge nogle af de sjældneste og mest giftige grundstoffer på…En ny forbindelse af curium (et radioaktivt, sjældent og kostbart grundstof) fotograferet ved LLNL under krystallografiske eksperimenter. Holdet fra LLNL og OSU brugte de såkaldte polyoxometalate liga
Udvikling af nye processer til at undersøge nogle af de sjældneste og mest giftige grundstoffer på…En ny forbindelse af curium (et radioaktivt, sjældent og kostbart grundstof) fotograferet ved LLNL under krystallografiske eksperimenter. Holdet fra LLNL og OSU brugte de såkaldte polyoxometalate liga
- Hvorfor bliver en lavest-masse-stjerne kæmpe?
- Hvilket station er sandt for videnskabelige teorier?
- Den første præcise måling af et enkelt molekyls effektive ladning
- Hvordan faktorekvationer
- Paganinis violin får røntgenbehandling på jagt efter lydhemmeligheder
- Hvad er denne bølgelængde i videnskabelig notation En mikrobølgeovn har en på 0,025 m?


