Bekæmpelse af kræft ved at mærke deres udløsere
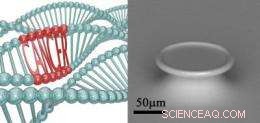
I DNA-gengivelsen til venstre, to af de tre DNA-strenge er "normale"; imidlertid, den tredje streng har en region, der kan forårsage kræft. Professor Armanis forskning er fokuseret på at opdage disse regioner og forstå, hvilke begivenheder der udløser ændringen i DNA'et. Teknikken, hun bruger, er afhængig af en meget følsom nanolaseranordning, som er vist på elektronmikroskopbilledet til højre. Laseren vist på dette billede er mindre end bredden af et menneskehår. Kredit:USC Viterbi School of Engineering.
Forestil dig den dag en maskine kan trække dit blod, screene det for genetiske mutationer og kemiske variationer, der kan forårsage kræft, og pop et lægemiddel, der er skræddersyet til dit DNA.
Det hypotetiske lægemiddel ville målrette mod - og rette op på de punkturegelmæssigheder, som er ophobet over tid, og som kan føre til dannelsen af tumorer - og kræft.
National Institutes of Health har anmodet Viterbi-professor Andrea Armani til at udvikle et nøgleinstrument, der tager forskere et skridt tættere på at realisere denne vision.
"Personlig indgivelse af kræftlægemidler? Afhængigt af tilgangen, det kan være så hurtigt som 10 til 15 år væk, " siger Armani, en adjunkt ved Mork Family Department of Chemical Engineering and Materials Science.
Armani har modtaget NIH's 2010 New Innovator Award, som anerkender en udvalgt gruppe af forskere med "ekstraordinær kreativitet" og dristige tilgange, der "har potentialet til at producere en stor indvirkning på brede, vigtige problemer i biomedicinsk og adfærdsmæssig forskning."
Prisen beløber sig til en forskningsbevilling på 2,3 millioner dollars over fem år til at undersøge epigenetik. Dette felt studerer ændringer i DNA, som er forbundet med kræft.
Analyse af disse DNA-ændringer har vist lovende i tidlig påvisning og behandling af æggestokkræft og andre typer kræft, siger Armani.
Men nuværende forskningsmetoder er kun i stand til at fange snapshots af disse DNA-ændringer, i stedet for at overvåge processen løbende. Derfor, de savner information, der kan være afgørende for at forstå processer, der har været forbundet med kræft og andre sygdomme, som Huntingtons og diabetes.
Følsomheden eller opløsningen af mange af disse teknikker er også meget dårlig. "Det er som at prøve at se et tv-program gennem statisk, " siger Armani.
Hendes metode vil skubbe feltet direkte til High-Definition.
Armani foreslår at udvikle en ultrafølsom nanolaser, der vil give hende mulighed for at opdage ændringer i DNA, mens de sker i realtid. Denne enhed vil også give hende mulighed for at studere en enkelt DNA-streng i isolation, snarere end grupper på hundreder til tusinder af tråde, som forskere skal gøre med den nuværende teknologi.
Da DNA binder til overfladen af nanolaseren, "farven" eller laserbølgelængden udsendt af laseren vil ændre sig. Når DNA'et ændrer sig, farven vil ændre sig igen. Den forbedrede opløsning er et resultat af den præcision, hvormed farven kan overvåges.
Den første del af projektet fokuserer på at bygge nanolaserinstrumentet, mens anden halvdel finansierer DNA-eksperimenterne.
Målet? Hvad Armani kalder "un-doing" disse triggere, der kan forårsage kræft.
Hun vil først fokusere på at bruge nanolaseren til at udføre indledende proof-of-concept eksperimenter ved hjælp af kendte triggere, så høje koncentrationer af almindelige opløsnings- og rengøringsmidler.
En del af denne proces involverer at tage en enkelt DNA-streng, at udsætte det for et hårdt kemikalie og se, om en specifik ændring igangsættes. I sidste ende vil hun gerne være i stand til at advare folk, hvilke triggere de skal undgå.
 Varme artikler
Varme artikler
-
 Video:Nanobots:Fremkomsten af de molekylære maskinerKredit:The American Chemical Society Nanomaskiner - inklusive motorer i nanostørrelse, raketter og endda biler - er mange størrelsesordener mindre end en menneskelig celle, men de har et kæmpe løf
Video:Nanobots:Fremkomsten af de molekylære maskinerKredit:The American Chemical Society Nanomaskiner - inklusive motorer i nanostørrelse, raketter og endda biler - er mange størrelsesordener mindre end en menneskelig celle, men de har et kæmpe løf -
 Ny metode designer nanomaterialer med mindre end 10 nanometer præcisionKrystaller af materialet sekskantet bornitrid kan ætses, så mønsteret du tegner øverst forvandler sig til en mindre og knivskarp udgave i bunden. Disse perforeringer kan bruges som en skyggemaske til
Ny metode designer nanomaterialer med mindre end 10 nanometer præcisionKrystaller af materialet sekskantet bornitrid kan ætses, så mønsteret du tegner øverst forvandler sig til en mindre og knivskarp udgave i bunden. Disse perforeringer kan bruges som en skyggemaske til -
 Hybrid nanogenerator høster hårdt tilgængelig havenergi(Venstre) Fotografi af hybrid nanogeneratoren (målestang:2 cm). (Center) Illustration af hybrid nanogeneratorstrukturen, sammen med fotografier af TENG og EMG i venstre og højre nederste panel, henhol
Hybrid nanogenerator høster hårdt tilgængelig havenergi(Venstre) Fotografi af hybrid nanogeneratoren (målestang:2 cm). (Center) Illustration af hybrid nanogeneratorstrukturen, sammen med fotografier af TENG og EMG i venstre og højre nederste panel, henhol -
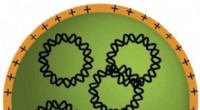 Hjernetumorceller penetreret af nedbrydelige nanopartikler, der bærer genetiske instruktionerBiologisk nedbrydelige plastikmolekyler (orange) samles selv med DNA-molekyler (sammenflettet, sorte cirkler) for at danne små nanopartikler, der kan bære gener til kræftceller. Kredit:Stephany Tzeng
Hjernetumorceller penetreret af nedbrydelige nanopartikler, der bærer genetiske instruktionerBiologisk nedbrydelige plastikmolekyler (orange) samles selv med DNA-molekyler (sammenflettet, sorte cirkler) for at danne små nanopartikler, der kan bære gener til kræftceller. Kredit:Stephany Tzeng
- Lokaliserede excitoner i 2-D materialer til integreret kvanteoptik
- Hvordan finder du ud af, om et signal fra rummet er en besked fra rumvæsener?
- NASA finder vindforskydning, der påvirker den tropiske cyklon Flamboyan
- Bedre adgang til retfærdighed er nødvendig for ofre for kønsbaseret vold
- Hvad er siliciumdioxid?
- Røntgenlasersyn afslører lægemiddelmål


