Små silicium-ilt-baserede polyeder kommer ind i cellulære kerner for at tænde dem selektivt
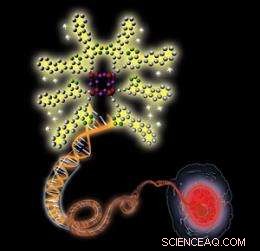
Skematisk illustration, der viser en positivt ladet nanoprobe (øverst til venstre), der binder til et negativt ladet dobbeltstrenget DNA-molekyle (i midten), resulterer i forbedret fluorescens, der tillader visualisering af en cellulær kerne (nederst til højre). Kredit:2010 Wiley-VCH
Kerner er komplekse, veldefinerede organeller, der bærer genetisk information, der er kritisk for cellen. Visualisering af disse organeller gennem fluorescensbilledteknikker lover at afsløre de mekanismer, der styrer genetisk information og giver måder at forudsige og behandle genetiske sygdomme. Arbejder tæt med Xinhai Zhang ved A*STAR Institute of Materials Research and Engineering, et forskerhold ledet af Bin Liu ved National University of Singapore har nu udviklet en metode til at oprette ultralette, stærkt selektiv fluorescerende nanoprober til en cellulær kerne billeddannelsesteknik kendt som to-foton exciteret fluorescens (TPEF) mikroskopi.
Forskere har foreslået en række fluorescerende stoffer for at belyse kerner i celler. Imidlertid, lysinducerede fænomener, såsom cellulær autofluorescens og alvorlig fotoskade, har en tendens til at forringe ydeevnen af disse sonder.
I TPEF -teknikken, hver nanoprobe producerer et fluorescerende signal ved ikke at absorbere én, men to lavenergifotoner af nær-infrarødt lys. Denne tofotonproces reducerer betydeligt virkningerne af fotoskader og cellulær autofluorescens, samtidig med at opløsningen forbedres, gør TPEF fordelagtig i forhold til traditionel en-foton fluorescensmikroskopi.
"TPEF-billeddannelse er mere kraftfuld end billeddannelse med én foton, især til in vivo og vævsbilleddannelse, hvor der findes stærk biologisk autofluorescens, ”Siger Zhang.
I stedet for en traditionel trin-for-trin syntese, forskerne vedtog en 'bottom-up' tilgang til at syntetisere nanoproberne til deres TPEF-skema. Disse nanoprober består af små uorganiske silicium -oxygenbure omgivet af korte positivt ladede polymerkæder. Holdet skaffede bure og kæder separat, før de sluttede dem sammen, og syntesen egner sig godt til at producere TPEF-nanoprober med forskellige lysemissionsfarver og biogenkendelsesfunktioner.
Den lille, stive bure letter inkorporeringen af proberne i cellulære kerner, mens de positivt ladede og lysfølsomme kæder bidrager til vandopløselighed og optiske egenskaber. Ifølge Liu, disse funktioner kombineres til i sidste ende at producere TPEF-egnede lysprober.
Teamet opdagede, at fluorescensen af proberne blev væsentligt mere intens ved udsættelse for nukleinsyrer, såsom dobbeltstrenget DNA og RNA. Dette skyldes, at de positivt ladede prober binder tæt til de negativt ladede nukleinsyrer gennem attraktive elektrostatiske interaktioner, forøgelse af probernes mikro-miljømæssige hydrofobicitet og deres fluorescens. Desuden, sonderne farvede selektivt kernerne i brystkræft og raske celler med lav toksicitet.
Forskerne udvider i øjeblikket deres probesamling til at omfatte andre intracellulære målapplikationer. De optimerer også yderligere probernes TPEF -ydelse. ”Disse nanoprober kan åbne op for nye måder at forhøre biologiske systemer på en høj kontrast og sikker måde, ”Siger Zhang.
 Varme artikler
Varme artikler
-
 Pyroelektriske peptidmikrorør gør varme til elektriske strømmeEt optisk billede af mikrorørbundtet placeret mellem to elektroder. Kredit:Kholkin et al., Anvendt fysik bogstaver Mange peptider og proteiner har en medfødt evne til at samles til lange, slanke f
Pyroelektriske peptidmikrorør gør varme til elektriske strømmeEt optisk billede af mikrorørbundtet placeret mellem to elektroder. Kredit:Kholkin et al., Anvendt fysik bogstaver Mange peptider og proteiner har en medfødt evne til at samles til lange, slanke f -
 Forskere kigger ind i nanoversetVed at bruge den nyeste teknologi, forskere ved Monash Center for Electron Microscopy (MCEM) har udviklet nye metoder, som gør det muligt at se og måle små forskydninger af atomer. Forskningen, udgiv
Forskere kigger ind i nanoversetVed at bruge den nyeste teknologi, forskere ved Monash Center for Electron Microscopy (MCEM) har udviklet nye metoder, som gør det muligt at se og måle små forskydninger af atomer. Forskningen, udgiv -
 Et stænk vaskemiddel gør katalytiske forbindelser mere kraftfuldeUnder højeffektmikroskopi, et pulver lavet med vaskemiddelbaseret teknologi hos Sandia National Laboratories består af perfekte kugler. Uden det, materialet ville ligne groft grus. Konsistens gør kata
Et stænk vaskemiddel gør katalytiske forbindelser mere kraftfuldeUnder højeffektmikroskopi, et pulver lavet med vaskemiddelbaseret teknologi hos Sandia National Laboratories består af perfekte kugler. Uden det, materialet ville ligne groft grus. Konsistens gør kata -
 Luminescerende nanokrystal-tags og højhastighedsscanner muliggør hurtig påvisning af flere patoge…J. Paul Robinson (Phys.org) – Et forskerhold, der bruger justerbare selvlysende nanokrystaller som tags til at fremme medicinsk og sikkerhedsmæssig billeddannelse, har med succes anvendt dem på hø
Luminescerende nanokrystal-tags og højhastighedsscanner muliggør hurtig påvisning af flere patoge…J. Paul Robinson (Phys.org) – Et forskerhold, der bruger justerbare selvlysende nanokrystaller som tags til at fremme medicinsk og sikkerhedsmæssig billeddannelse, har med succes anvendt dem på hø


