Bakteriel rustning har spor til selvsamlende nanostrukturer

Mange bakterier og archaea indkapsler sig i en selvsamlende beskyttende skal af S-lagproteiner, som chainmail rustning. Processen er en model for selvsamling af 2D og 3D organiske og uorganiske nanostrukturer.
Forestil dig tusindvis af eksemplarer af et enkelt protein, der organiseres i et lag med kædepostrustning, der beskytter bæreren mod barske og stadigt skiftende miljøforhold. Det er tilfældet for mange mikroorganismer. I en ny undersøgelse, forskere ved US Department of Energy (DOE) s Lawrence Berkeley National Laboratory (Berkeley Lab) har afdækket nøgledetaljer i denne naturlige proces, der kan bruges til selvsamling af nanomaterialer i komplekse to- og tredimensionelle strukturer.
Caroline Ajo-Franklin, en kemiker og syntetisk biolog ved Berkeley Labs Molecular Foundry, ledet denne undersøgelse, hvor målinger med høj gennemstrømning af lysspredning blev brugt til at undersøge selvsamlingen af 2D-nanosheets fra et fælles proteinoverfladelag (S-lag) protein. Dette protein, kaldet "SbpA, "danner den beskyttende rustning til Lysinibacillus sphaericus, en jordbakterie, der bruges som toksin til bekæmpelse af myg. Deres undersøgelse viste, at calciumioner spiller en central rolle i, hvordan denne rustning samles. Faktisk to nøgleroller.
"Calciumioner udløser ikke kun foldning af proteinet i den korrekte form til dannelse af nanosheet, men også tjene til at binde nanosheetene sammen, "Siger Ajo-Franklin." Ved at etablere og bruge lysspredning som en proxy for dannelse af SbpA nanosheet, vi var i stand til at bestemme, hvordan varierende koncentrationer af calciumioner og SbpA påvirker størrelsen og formen af S-lags rustning. "
Detaljer om denne undersøgelse er blevet offentliggjort i tidsskriftet ACS Nano i et papir med titlen "Ionspecifik kontrol af selvmonteringsdynamikken for et nanostruktureret proteingitter." Ajo-Franklin er den tilsvarende forfatter. Medforfattere er Behzad Rad, Thomas Haxton, Albert Shon, Seong-Ho Shin og Stephen Whitelam.
I den mikrobielle verden af bakterier og archaea, eksterne trusler florerer. Deres omgivende miljø kan overgå fra ekstrem varme til ekstrem kulde, eller fra meget sur til meget basisk. Rovdyr er overalt. For at beskytte sig selv, mange bakterier og archaea indkapsler sig inden i en skal af S-lag proteiner. Mens forskere har kendt til denne beskyttende belægning i mange år, hvordan det dannes har været et mysterium.
Ajo-Franklin og hendes kolleger har undersøgt selvsamlende proteiner som et potentielt middel til at skabe nanostrukturer med kompleks struktur og funktion.
"På Molecular Foundry, vi er blevet rigtig gode til at lave nanomaterialer i forskellige former, men vi lærer stadig, hvordan vi samler disse materialer til organiserede strukturer, "siger hun." S-lags proteiner er rigelige biologiske proteiner, der vides at samle sig til 2D krystallinske nanosark med gittersymmetrier og porestørrelser, der er omtrent de samme dimensioner som kvantepunkter og nanorør. Dette gør dem til et overbevisende modelsystem til oprettelse af nanostrukturerede arrays af organiske og uorganiske materialer på en bottom-up måde. "
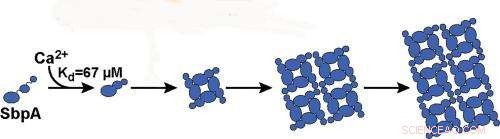
Bindingen af calciumioner til SbpA-proteiner starter processen, hvorved SbpA selv samler sig til nanosheets. Ca2+ binder til SbpA med en affinitet på 67 μM. Kredit:Billede med tilladelse fra Ajo-Franklin-gruppen, Berkeley Lab
I denne seneste undersøgelse, lysspredningsmålinger blev brugt til at kortlægge diagrammer, der afslørede det relative udbytte af selvsamlede nanosheets over en lang række koncentrationer af SbpA og calciumioner. Ud over, virkningerne af at erstatte mangan- eller bariumioner med calciumioner blev undersøgt for at skelne mellem en kemisk specifik og generisk divalent kationrolle for calciumionerne. Behzad Rad, hovedforfatteren af ACS Nano papir, og kolleger fulgte lysspredning af lys i det synlige spektrum. De korrelerede derefter signalet til dannelse af nanosheet ved hjælp af elektronmikroskopi og Small Angle X-ray Scattering (SAXS), en teknologi, der kan give information om molekylære samlinger i næsten enhver form for løsning. SAXS -målingerne blev opnået ved "SIBYLS beamline (12.3.1) i Berkeley Labs Advanced Light Source.
"Vi lærte, at kun calciumioner udløser SbpA-selvsamlingsprocessen, og at koncentrationerne af calciumioner inde i cellen er for lave til, at nanosheets kan dannes, hvilket er godt for bakterien, "siger Rad." Vi fandt også ud af, at tidsudviklingen af lysspredningssporene er i overensstemmelse med den irreversible vækst af ark fra en ubetydelig lille kerne. Så snart fem calciumioner binder til et SbpA -protein, processen starter, og krystallen vokser virkelig hurtigt. Den lille kerne er det, der får vores lysspredningsteknik til at fungere. "
Ajo-Franklin, Rad og deres medforfattere mener, at deres lysspredningsteknik er anvendelig på enhver type protein, der selv samler sig til 2D-nanosheets, og kan bruges til at overvåge vækst fra nanometer til mikrometer skalaer.
I betragtning af S -lag -proteinernes robuste karakter og deres klæbende kvalitet - bakterier bruger deres S -lags rustning til at knytte sig til deres omgivelser - er der mange spændende applikationer, der venter på yderligere undersøgelser.
"Et projekt, vi undersøger, er at bruge SbpA -proteiner til at lave klæbende nanostrukturer, der kan bruges til at fjerne metaller og andre forurenende stoffer fra vand, "Ajo-Franklin siger." Nu hvor vi har så godt styr på, hvordan SbpA-proteiner samler sig selv, vi vil gerne begynde at blande og matche dem med andre molekyler for at skabe nye og nyttige strukturer. "
 Varme artikler
Varme artikler
-
 Forskere afslører egenskaber i nanokompositoxidkeramik til reaktorbrændstofSkematisk afbildning af forskellige dislokationsnetværk for SrO- og TiO2-termineret SrTiO3/MgO-grænseflade. Kredit:Los Alamos National Laboratory Nanokompositoxidkeramik har potentielle anvendelse
Forskere afslører egenskaber i nanokompositoxidkeramik til reaktorbrændstofSkematisk afbildning af forskellige dislokationsnetværk for SrO- og TiO2-termineret SrTiO3/MgO-grænseflade. Kredit:Los Alamos National Laboratory Nanokompositoxidkeramik har potentielle anvendelse -
 Højeffektive solceller kan være resultatet af kvanteprikforskningXiaoyang Zhu og kolleger opdagede, at varme elektroner kan overføres fra fotoexciterede blyselenid-nanokrystaller til en elektronleder lavet af titaniumdioxid. Deres opdagelse viser vejen mod mere eff
Højeffektive solceller kan være resultatet af kvanteprikforskningXiaoyang Zhu og kolleger opdagede, at varme elektroner kan overføres fra fotoexciterede blyselenid-nanokrystaller til en elektronleder lavet af titaniumdioxid. Deres opdagelse viser vejen mod mere eff -
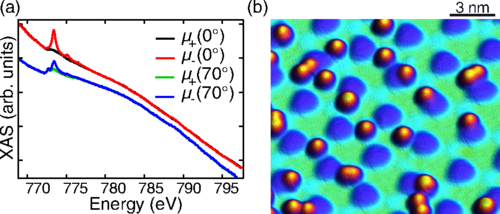 Forskere finder magnetisk tilstand af atomer på grafenplade påvirket af substrat, det er vokset på(a) Normaliserede XAS -spektre af Co -atomer på G/Ru (0001) taget ved normal og græsningsindfald. Spektrene er forskudt for klarhedens skyld. (b) STM-billede af 0,008 ML Co på G/Ru(0001). Kredit: Phys
Forskere finder magnetisk tilstand af atomer på grafenplade påvirket af substrat, det er vokset på(a) Normaliserede XAS -spektre af Co -atomer på G/Ru (0001) taget ved normal og græsningsindfald. Spektrene er forskudt for klarhedens skyld. (b) STM-billede af 0,008 ML Co på G/Ru(0001). Kredit: Phys -
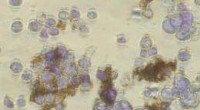 Magnetiske nanopartikler viser løfte om at bekæmpe kræft hos menneskerNanopartikler, i brun, binder sig til kræftceller, i violet, fra menneskets bughule. Kredit:Ken Scarberry/Georgia Tech Forskere ved Georgia Tech og Ovarian Cancer Institute har videreudviklet en p
Magnetiske nanopartikler viser løfte om at bekæmpe kræft hos menneskerNanopartikler, i brun, binder sig til kræftceller, i violet, fra menneskets bughule. Kredit:Ken Scarberry/Georgia Tech Forskere ved Georgia Tech og Ovarian Cancer Institute har videreudviklet en p
- Smarte sensorer kan transformere, hvordan bygninger er designet og besat
- At få de/dem pronominer rigtige
- Ægteskab kun et klik væk for Chinas desperate enlige mænd
- Video:Forberedelse af MetOp-C
- Tak månen for Jordens forlængelsesdag
- Fransk industri kommer på stranden for at bejle til fremtidige rekrutter


