Innovativ lysterapi når dybe tumorer

Ved at bruge en musemodel af kræft, forskere ved Washington University School of Medicine i St. Louis har udtænkt en måde at anvende lysbaseret terapi på dybe væv, som aldrig tidligere har været tilgængelige. I stedet for at lyse udefra, de leverede lys direkte til tumorceller, sammen med en lysfølsom kilde til frie radikaler, der kan aktiveres af lyset for at ødelægge kræft. Og de opnåede dette ved at bruge materialer, der allerede er godkendt til brug hos kræftpatienter. Lyskilden produceres under positron emission tomografi (PET) scanninger, som læger bruger til at diagnosticere kræft. De lysfølsomme materialer er titaniumdioxid nanopartikler. Her er vist en sådan partikel (lilla), der bærer det jernbindende protein transferrin (blå og grøn) og det lysfølsomme kræftlægemiddel titanocen (rødt). Undersøgelsen vises 9. marts i tidsskriftet Natur nanoteknologi . Kredit:N. Kotagiri
Light long er blevet brugt til at behandle kræft. Men fototerapi er kun effektiv, hvor lys let kan nå, begrænser dets anvendelse til kræft i huden og i områder, der er tilgængelige med et endoskop, såsom mave-tarmkanalen.
Ved at bruge en musemodel af kræft, forskere ved Washington University School of Medicine i St. Louis har udtænkt en måde at anvende lysbaseret terapi på dybe væv, som aldrig tidligere har været tilgængelige. I stedet for at lyse udefra, de leverede lys direkte til tumorceller, sammen med en lysfølsom kilde til frie radikaler, der kan aktiveres af lyset for at ødelægge kræft. Og de opnåede dette ved at bruge materialer, der allerede er godkendt til brug hos kræftpatienter.
Undersøgelsen vises 9. marts i tidsskriftet Natur nanoteknologi .
"Fototerapi virker meget godt og har få bivirkninger, men det kan ikke bruges til dybt indlejrede eller metastatiske tumorer, " sagde seniorforfatter Samuel Achilefu, PhD, professor i radiologi og i biomedicinsk teknik ved Washington University. "Generelt, lysfølsomme materialer genererer frie radikaler, der er meget giftige og inducerer celledød. Men teknikken har kun fungeret godt, når lys og ilt kan komme dertil. Behovet for ilt og den overfladiske penetration af lys i væv har begrænsede fremskridt på dette område i årtier."
Den lyskilde, som forskerne brugte, er afhængig af et fænomen kaldet Cerenkov-stråling, identificeret i 1930'erne af Pavel Cerenkov, som senere vandt Nobelprisen i fysik for opdagelsen. Cerenkov-stråling er ansvarlig for den karakteristiske blå glød fra undersøiske atomreaktorer. Det er også produceret under positron emission tomografi (PET) scanninger, som læger bruger til at diagnosticere kræft.
Achilefu og førsteforfatter Nalinikanth Kotagiri, MD, PhD, en postdoc forsker, fokuseret på en meget brugt billeddannelsesstrategi kaldet FDG-PET. Med denne teknik, patienter gennemgår en PET-scanning efter at have modtaget en intravenøs dosis af radioaktivt mærkede sukkermolekyler kaldet fluordeoxyglucose (FDG). Mange tumorer optager sukkeret for at understøtte deres hurtige vækst, og den vedhæftede radioaktive fluor får disse tumorer til at lyse op på en PET-scanning, uanset hvor de er i kroppen.
Forskerne antog, at det radioaktive fluor også ville producere nok Cerenkov-stråling til at aktivere et fotosensibiliserende middel, hvis det også kunne leveres til det samme sted.
På denne måde FDG kunne tjene to formål, fortsætter sin rolle som billeddannende middel og tilføjer det nye job med at levere lys til fototerapi, ifølge Kotagiri.
"FDG er et af de mest udbredte billeddannende midler i verden, " sagde Achilefu. "Det er skønheden ved dette behandlingsparadigme. Det bruges i dag på hospitaler til at finde primær og metastatisk kræft. Så med FDG som vores lyskilde, vi havde brug for at finde et materiale, der bliver giftigt, når det udsættes for det lys, det producerer."
Efter at have set på en række muligheder, forskerne fokuserede på nanopartikler lavet af titaniumdioxid, et mineral med bred anvendelse i medicin og industri, herunder i hofteimplantater, solcreme, tandpasta og fødevaretilsætningsstoffer. Når de udsættes for lys, titaniumdioxid producerer frie radikaler uden at kræve ilt til reaktionen. For at se om de kunne øge styrken af nanopartiklerne, efterforskerne tilføjede også et lægemiddel kaldet titanocen til nanomaterialets overflade.
"Titanocene er blevet godkendt til forsøgsbrug hos mennesker, " sagde Achilefu. "Det gik hele vejen til fase 2 kliniske forsøg som et kemoterapimiddel. Det viste sig at være sikkert, men det virkede ikke så godt sammenlignet med placebo. Stadig, det er også kendt for at interagere med lys med lav intensitet og bryde ind i frie radikaler. Vi besluttede os for at se, om vi kunne lære det at gøre sit arbejde anderledes - at fungere som et fototerapeutisk lægemiddel i stedet for et kemoterapeutisk lægemiddel."
For at hjælpe nanopartiklerne ind på tumorer i mus, forskerne har også belagt partiklerne med et protein kaldet transferrin, der binder sig til jern i blodet. Ligesom sukker, mange tumorer er afhængige af jern for at vokse. Achilefu påpegede, at dette jernbindende protein blot er et eksempel på en måde at målrette nanopartiklerne mod kræftceller.
Forskerne testede forskellige formuleringer af nanopartiklerne og kræftlægemidlet kombineret med FDG-lyskilden i mus med humane lungetumorer og fibrosarkom, en tumor i bindevævet. Ved at sammenligne disse mus med ubehandlede mus, de testede følgende kombinationer:FDG plus tumorsøgende nanopartikler alene (intet kræftlægemiddel), FDG plus tumorsøgende kræftlægemiddel alene (ingen nanopartikler), og FDG plus tumorsøgende nanopartikler, der bærer kræftlægemidlet.
Når det injiceres i blodbanen med FDG, de tumorsøgende nanopartikler, der bar kræftlægemidlet, havde den mest markante effekt. Femten dage efter behandlingen, tumorer hos behandlede mus var otte gange mindre end hos ubehandlede mus.
Mus, der modtog FDG plus tumorsøgende nanopartikler alene, overlevede omkring 30 dage sammenlignet med et gennemsnit på 15 dage for ubehandlede mus. De fandt også omtrent den samme 30-dages overlevelse for mus, der modtog FDG plus kun det tumorsøgende kræftlægemiddel - uden nanopartiklerne. Overlevelsen steg til 50 dage for mus, der fik alle tre komponenter:FDG plus de tumorsøgende nanopartikler, der bærer kræftlægemidlet.
"Udsat for lyskilden, titaniumdioxid nanopartiklerne alene kan dræbe kræft, " sagde Achilefu. "Men tilføjelsen af lægemidlet ser ud til at forbedre det terapeutiske resultat. De to sammen producerer forskellige slags frie radikaler, der overvælder tumorceller. Vores formulering bruger også doser af lægemidlet, der er meget lavere, end det ville blive givet til kemoterapi."
Kotagiri tilføjede, at toksiske bivirkninger bør være minimale. Både lyset og det lysfølsomme materiale er målrettet mod tumoren, og materialet er ikke giftigt, medmindre det aktiveres af lyskilden, som kun bør forekomme på tumorstedet.
Achilefu og Kotagiri planlægger et lille klinisk forsøg med mennesker for at evaluere de let tilgængelige komponenter i denne strategi, begyndende med FDG kombineret med forsøgsmedicinen mod kræft.
 Varme artikler
Varme artikler
-
 Forskerhold udvikler omkostningseffektiv teknik til masseproduktion af grafen af høj kvalitetKredit:AlexanderAlUS/Wikipedia/CC BY-SA 3.0 Et forskerhold ledet af National University of Singapore (NUS) har udviklet en økonomisk og industrielt levedygtig strategi til fremstilling af grafen.
Forskerhold udvikler omkostningseffektiv teknik til masseproduktion af grafen af høj kvalitetKredit:AlexanderAlUS/Wikipedia/CC BY-SA 3.0 Et forskerhold ledet af National University of Singapore (NUS) har udviklet en økonomisk og industrielt levedygtig strategi til fremstilling af grafen. -
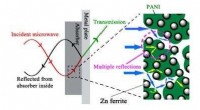 Komposit reducerer betydeligt elektromagnetisk forureningEt skematisk diagram over faseannullering og mikrobølgedæmpningsproces. Den luftige struktur af PANI/Fe ferritkomposit kan i høj grad øge transmissionsvejen for mikrobølger, og de mange refleksioner k
Komposit reducerer betydeligt elektromagnetisk forureningEt skematisk diagram over faseannullering og mikrobølgedæmpningsproces. Den luftige struktur af PANI/Fe ferritkomposit kan i høj grad øge transmissionsvejen for mikrobølger, og de mange refleksioner k -
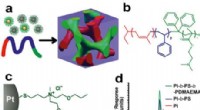 Nanopartikelnetværksdesign forstærket af teoriA:En skematisk fremstilling af blokcopolymer-syntesemetoden, der omfatter selvmontering af guld og platin-nanopartikler. B. Molekylær struktur af den anvendte blokcopolymer. C. Molekylær struktur af s
Nanopartikelnetværksdesign forstærket af teoriA:En skematisk fremstilling af blokcopolymer-syntesemetoden, der omfatter selvmontering af guld og platin-nanopartikler. B. Molekylær struktur af den anvendte blokcopolymer. C. Molekylær struktur af s -
 Snakes ultrasorte pletter kan hjælpe højteknologisk søgenEn gaboon hugorm ses i fangenskab den 17. januar, 2010 i Las Vegas, Nevada. Forskere har identificeret nanostrukturer i de ultrasorte hudaftegninger på en afrikansk hugorm, som de sagde torsdag kunne
Snakes ultrasorte pletter kan hjælpe højteknologisk søgenEn gaboon hugorm ses i fangenskab den 17. januar, 2010 i Las Vegas, Nevada. Forskere har identificeret nanostrukturer i de ultrasorte hudaftegninger på en afrikansk hugorm, som de sagde torsdag kunne
- Sidste måned var den varmeste januar nogensinde, Det siger amerikanske videnskabsmænd
- Water Dam Science Projects
- Kulafbrænding skal bremses, hvis den globale opvarmning skal begrænses til 1,5 C i dette århundre…
- Asteroide på størrelse med skolebus for at zoome sikkert forbi Jorden
- Forskerteam gemmer oplysninger om et enkelt molekyle
- Oplysninger om de fire regioner i California


